度拉糖肽(TRULICITYTM)等融合蛋白治疗药物的开发日益增加,因此需要可用于快速开发LC-MS/MS定量测定方法的通用工作流程。本文介绍含Fc的治疗药物测定方法开发的完整工作流程。利用肽图分析实验表征和鉴定适合定量的肽。然后通过自动化MassLynx Skyline Interface工作流程优化MRM。以通用的免疫亲和捕获方法、快速且可重现的酶解工作流程以及选择性肽SPE制备样品以进行分析。该测定方法使度拉糖肽的定量下限达到1 ng/mL,成功用于大鼠PK研究中的分析。
对于诸如融合蛋白这样的新一代治疗药物,使用支持快速开发LC-MS/MS定量测定方法的工作流程非常重要。虽然LC-MS/MS测定在药物发现和开发实验室中无处不在,但在快速表征和选择待优化的目标肽段方面,方法开发过程仍有改进的空间。本文介绍依次使用Xevo G2-XS QTof(快速表征)和三重四极杆Xevo TQ-XS系统(快速定量)对度拉糖肽(GLP-1类似物与IgG4 Fc的融合蛋白)进行快速蛋白质确认、肽鉴定、选择和优化的整个过程。本应用纪要的姊妹篇(720006823EN)1更详细地讨论了最终LC-MS/MS方法和生物分析测定的优点。
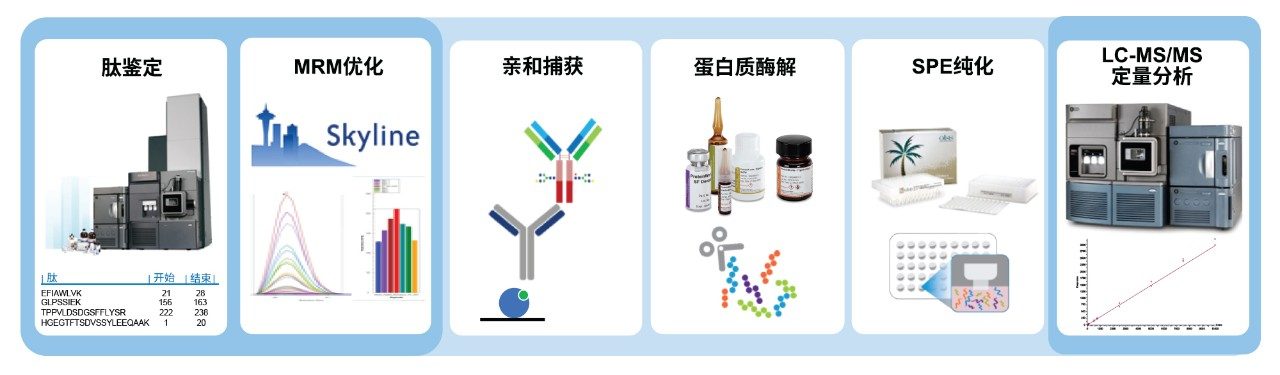
理想情况下,设计测定方法的工作流程由以下步骤组成(图1);
1) HRMS确认和表征
a. 执行肽图分析实验以确认肽段
b. 确定适合定量监测的肽(稳定性、脱酰胺、修饰水平)
2) 三重四极杆优化和分析
a. MRM通道的快速选择和优化
b. 样品前处理方法的优化(详见应用纪要720006823EN)1
本应用纪要展示了快速表征、确认序列以及应用这些信息创建大鼠药代动力学(PK)研究中度拉糖肽分析方法所需的步骤。HRMS平台本身也具有运行测定方法的能力,但本工作流程介绍在三重四极杆平台上运行分析以大幅提升通量的更常规的方法2。 该方法使定量下限达到1 ng/mL (0.02 M),因此能够对度拉糖肽进行高灵敏度定量分析。
利用ProteinWorks Auto eXpress小体积方案(部件号:176004077)对度拉糖肽的净稀释液进行酶解。简单来讲,就是将度拉糖肽稀释至300 µg/mL (24 µg),用RapiGest SF表面活性剂进行变性处理,然后用二巯基苏糖醇还原,再用碘乙酰胺烷基化。使用胰蛋白酶按照1:10胰蛋白酶:蛋白质(w/w)的比率酶解样品,并用甲酸淬灭。将10 µL(约1.5 µg)样品注入ACQUITY UPLC I-Class PLUS和Xevo G2-XS QTof质谱仪系统,使用LC-MSE进行肽图分析。使用Xevo TQ-XS质谱仪进行MassLynx Skyline Interface MRM优化实验,每次运行的进样体积为1 µL。
以1 mg/kg的剂量向六只大鼠皮下注射度拉糖肽,在给药前采集血样,并在给药后2、4、7、24、48、72、96、120和168小时再次采集血样。完整的样品前处理说明请参见应用纪要720006823EN。
|
LC系统: |
ACQUITY UPLC I-Class PLUS(固定定量环) |
|
检测条件: |
Xevo G2-XS QTof质谱仪,ESI+ |
|
样品板: |
具有MaxPeak高性能表面的QuanRecovery 96孔板 |
|
色谱柱: |
ACQUITY UPLC Peptide BEH C18, 300 Å, 1.7 µm, 2.1 × 100 mm |
|
柱温: |
60 oC |
|
样品温度: |
10 oC |
|
进样体积: |
10 µL |
|
流速: |
0.2 mL/min |
|
流动相A: |
0.1%甲酸的水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度: |
流动相B在50分钟内由1%增加至35%,流速0.2 mL/min,然后进行色谱柱清洗和平衡 |
|
MS系统: |
Xevo G2-XS QTof质谱仪,ESI+ |
|
电离模式: |
ESI+ |
|
毛细管电压: |
1.2 kV |
|
锥孔电压: |
40 V |
|
离子源温度: |
150 oC |
|
脱溶剂气温度: |
350 oC |
|
锥孔气流速: |
20 L/h |
|
脱溶剂气流速 |
600 L/h |
|
MS软件 |
UNIFI (v.1.9.4) |
|
信息学软件 |
UNIFI (v.1.9.4) |
完整的LC-MS/MS条件参见应用纪要720006823EN。
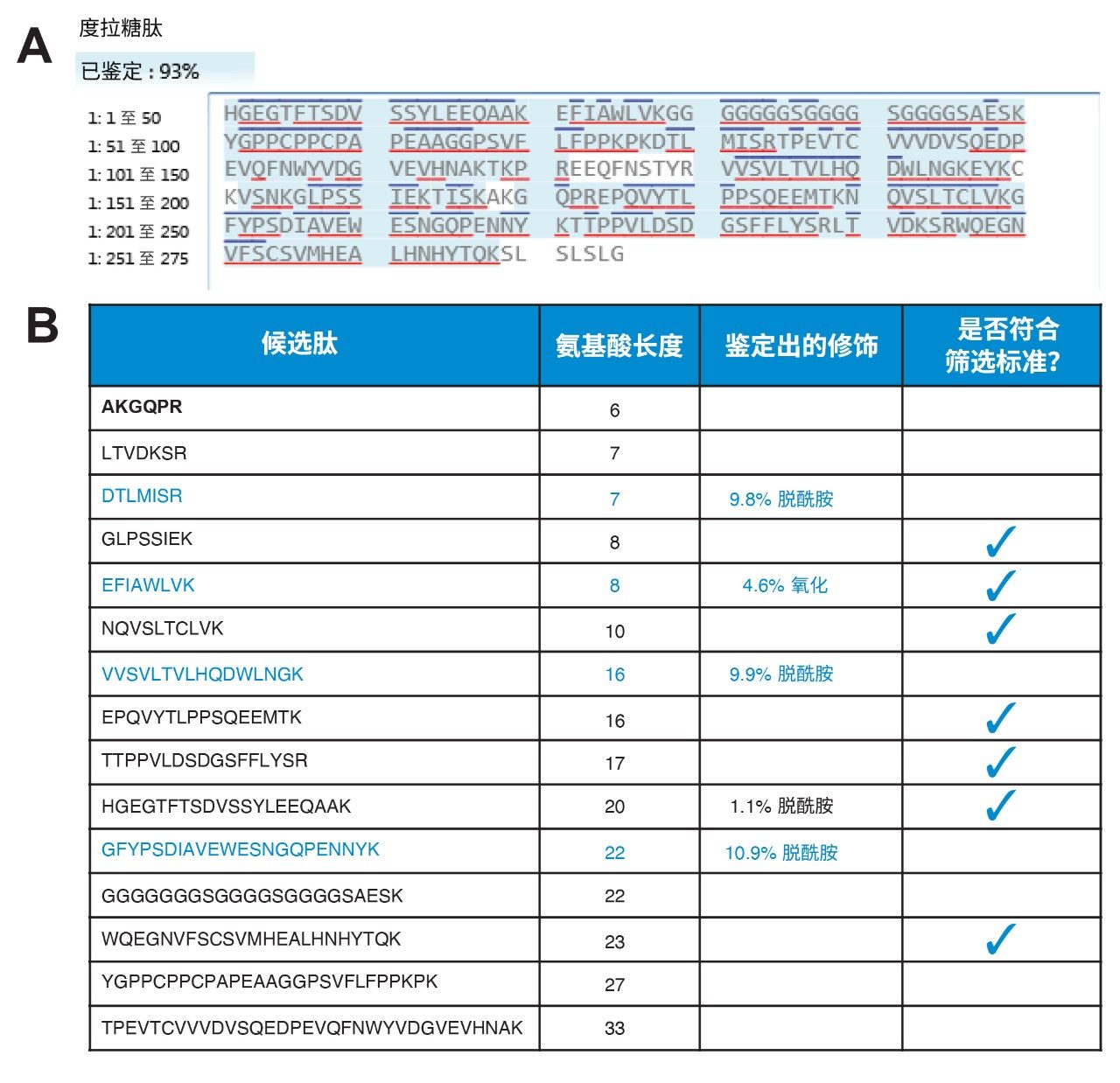
可通过肽图分析实验鉴定适合定量的肽。下游样品前处理步骤包括通过ProteinWorks Auto eXpress Low快速酶解试剂盒酶解度拉糖肽。尽管该试剂盒不适用于通常使用测序级物质(成本较高)的肽图分析应用,但它使我们能够通过胰蛋白酶酶解(使用预期的样品前处理方法)来鉴定从蛋白质中释放出的肽段并评估其行为。这些方法鉴定度拉糖肽肽段的序列覆盖率高达93%(图2,A图)。
肽修饰和缺失的裂解也能轻松鉴定。度拉糖肽的肽图分析实验确定了15种胰蛋白酶解肽,长度范围在6~33个氨基酸内(少于6个氨基酸的肽由于特异性和保留性较差,已从该列表中排除)。在该列表(图2,B图)中,基于氨基酸长度(8~25个残基)和确定的修饰百分比进一步筛选肽段。EFIAWLVK是一种发生高水平修饰的肽,由于在Fc融合蛋白中处于独特位置,因此也保留在筛选后的肽列表中。这种肽来自蛋白质的GLP-1区域,是该区域中仅有的2个肽段之一。筛选后的肽列表构成下一步开发测定方法、优化MRM通道的基础。
Skyline(华盛顿大学MacCoss Labs)是一款开源软件,已与MassLynx软件集成,可以提供无缝工作流程进行MRM鉴定和优化(碰撞能量、保留时间安排、驻留时间等),还可以节省数天至数周的优化和开发时间3。 MSI可自动执行采集方法创建、数据采集和数据查看等多个步骤,筛选每种蛋白质中高度灵敏的肽以及每种肽中高度灵敏的通道用于最终方法。肽生物分析工作流程的示例见图3。

步骤A – 保留时间对齐和母离子选择
步骤B – MRM鉴定
步骤C – MRM优化
步骤D – 最终方法创建
通过Skyline优化肽段后,必须评估MRM通道在所需生物基质中的灵敏度和选择性。选择性最高的MRM通道,其母离子和子离子m/z值通常较高。
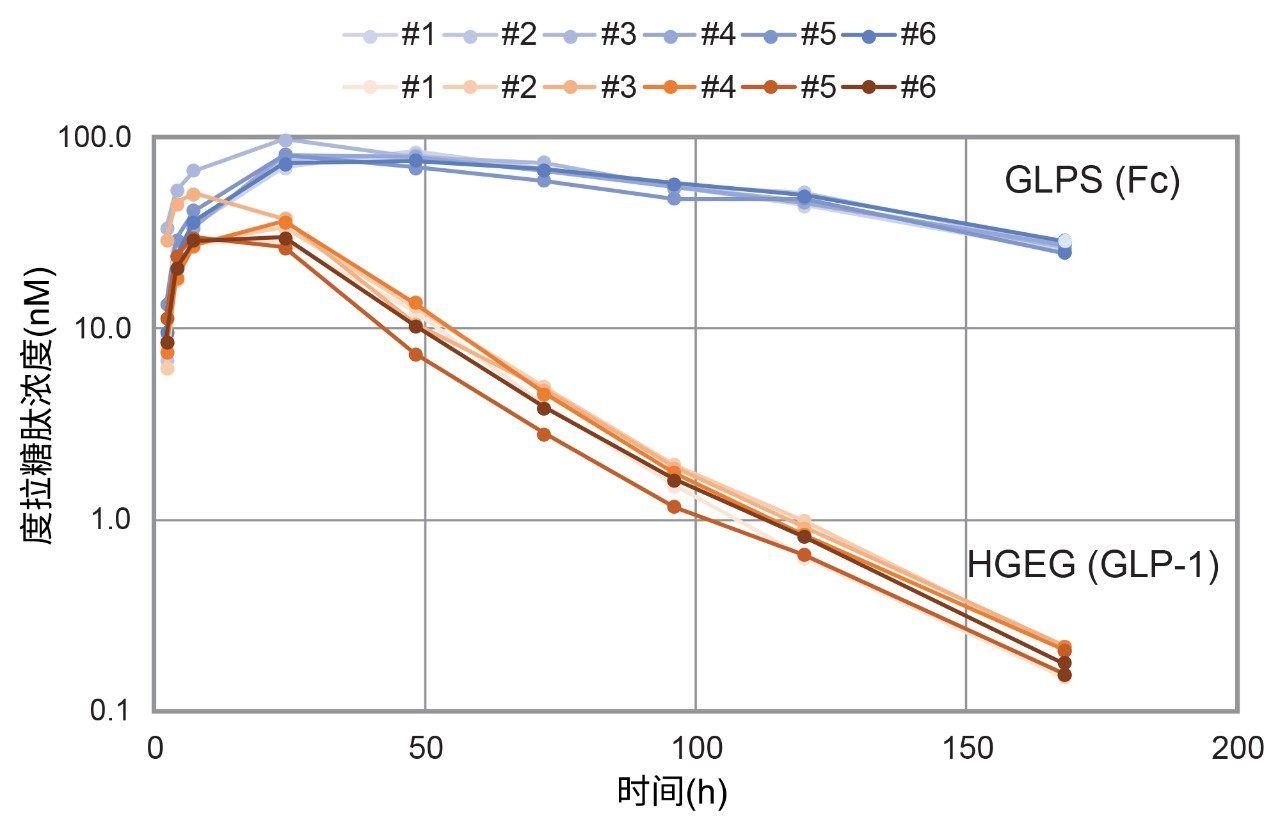
将本文所述工作流程应用于开发灵敏的测定方法,以支持定量分析从大鼠血浆中提取的度拉糖肽。给予大鼠度拉糖肽,并在给药前,以及给药后168小时采集样品,检查度拉糖肽在大鼠中的药代动力学(PK)特性。为深入了解整个度拉糖肽蛋白,同时从GLP-1和Fc区域中选择特征性肽段。选择GLP-1的N端肽HGEGTFTSDVSSYLEEQAAK (HGEG)作为包含至少一个GLP-1序列拷贝的完整融合蛋白的替代物。从蛋白质的Fc区域中选择GLPSSIEK (GLPS)代替总体Fc水平。
PK特征(图4)展示了HGEG和GLPS肽的差异清除。测得生物治疗药物的半衰期(使用HGEG肽)为22.9小时(使用PKSolver计算),与先前文献报道的结果一致4-6。GLPS肽的半衰期延长了大约3倍,可能是由于血浆中有完整GLPS肽以及度拉糖肽的GLP-1区域发生蛋白酶裂解产生了游离GLPS7。 必须了解生物治疗药物的性质,才能明智地选择肽,并在PK研究中清楚地了解的整个蛋白质行为。
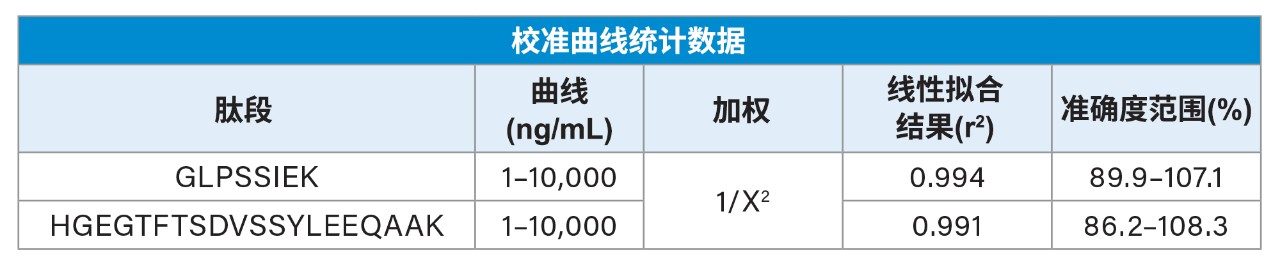
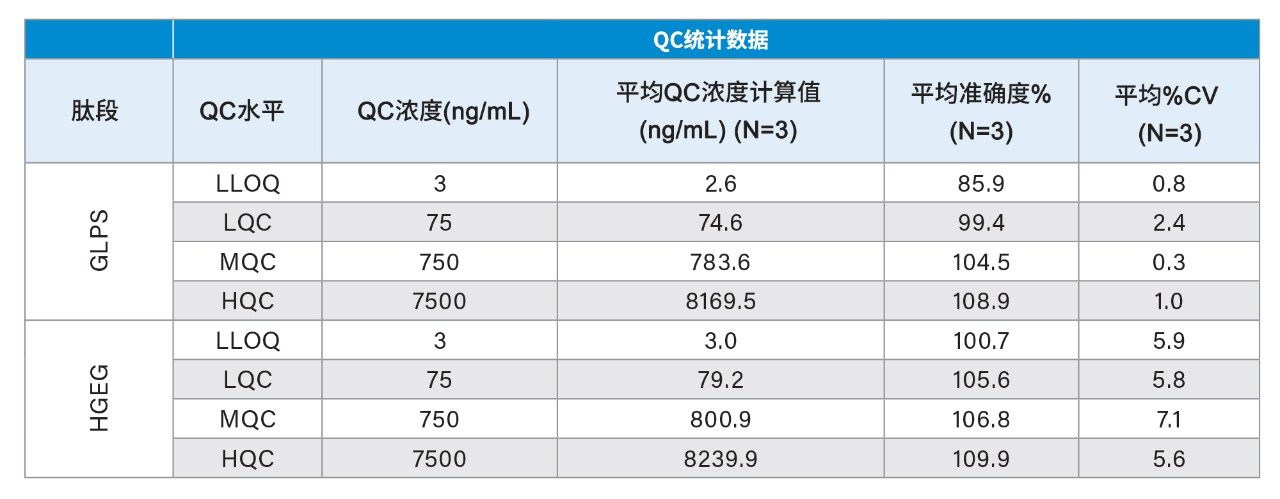
使用50 μL大鼠血浆,经过免疫纯化、酶解和SPE纯化后,对度拉糖肽实现了线性、精密且准确的定量分析。定量下限(LLOQ)达到1 ng/mL (0.02 nM),使用1/X2线性拟合获得的校准曲线在1~10,000 ng/mL (0.02~167.59 nM)范围内呈线性(r2>0.99)(表1)。QC水平准确度在±15%范围内,CV<7%,与标准生物分析方法验证指南的指标一致。所有运行的QC性能统计数据见表2。
本文介绍用于特征性肽段鉴定和优化的完整工作流程,并将该工作流程应用于度拉糖肽定量测定方法的开发。结合先进的样品前处理技术,以高准确度和高精密度分析大鼠PK样品。
720006969ZH,2020年8月