
ACQUITY UPLC PLUS系列专为改善UPLC技术的易操作性而设计,同时可保持与传统ACQUITY UPLC平台(如H-Class和I-Class系统)相当的分析性能。本应用纪要将展示ACQUITY UPLC PLUS系统应用于各种生物制药应用(包括游离寡糖分析、体积排阻色谱(SEC)分析和肽图分析)时表现出的等效性和卓越的稳定性。
由于能够有效治疗各种疾病,生物治疗药物已经成为一个快速增长的市场,而生物制药分析需要经济有效并能高效提供稳定结果的分析仪器。要解决成本、效率和稳定性挑战,一种有效的方法是在整个产品生命周期中运用创新技术。作为生物药物开发和生产过程不可缺少的组成部分,液相色谱(LC)平台有望通过技术现代化成为制药质控体系的一部分,用于提高整个制药工艺流程的生产效率。为此,超高效液相色谱(UPLC)仪器已被应用于生物药物开发和生产的各个环节,大幅提高了分析性能、生产效率并降低了成本。随着制药公司为了加速产品上市而不断对LC系统提出更高要求,稳定性更高、停机时间更短的仪器将更具优势。
ACQUITY UPLC PLUS系列专为改善UPLC技术的易操作性而设计,同时可保持与传统ACQUITY UPLC平台(如H-Class和I-Class系统)相当的分析性能。如图1所示,沃特世在现有ACQUITY UPLC系统系列产品的基础之上,对溶剂管理器和样品管理器进行了多项改进。脱气机硬件和固件的改进可以提高分离的重现性,同时最大程度延长系统正常运行时间,而采用全新设计的溶剂管理器则能够改善热敏样品的完整性。此外,进样针外表面经过专门处理,扩展了针的兼容性,使其不仅能与更多种样品瓶盖和孔板盖配合使用,还显著改善了残留性能。这些系统改进是专门设计的,目的是让ACQUITY UPLC PLUS系列保持与它们将要替代的ACQUITY UPLC系列相同的系统延迟体积和扩散特性,从而确保两个平台具有相同的分离性能。综上所述,ACQUITY UPLC PLUS系列产品极大改善了用户体验,能够最大限度延长系统正常运行时间,让分析人员安心无忧,同时确保运行已有方法时可获得与原系统相当的性能。

本应用纪要将展示ACQUITY UPLC PLUS系统应用于各种生物制药应用(包括游离寡糖分析、体积排阻色谱(SEC)分析和肽图分析)时表现出的等效性和卓越的稳定性。为了评估ACQUITY UPLC PLUS系统的性能,本研究分别比较了ACQUITY UPLC H-Class PLUS Bio系统与ACQUITY UPLC H-Class Bio系统,以及ACQUITY UPLC I-Class PLUS与ACQUITY UPLC I-Class系统。
按照之前发表的应用纪要中所述的方法制备游离寡糖样品1。 简言之,就是将RapiFluor-MS游离寡糖性能标准品(部件号186007983)溶于25 µL DMF/乙腈/水混合溶液中(比例为22.5/55.5/22)。LC-MS级水和乙腈购自Fisher Scientific。将1瓶(10 mL)游离寡糖分析专用的沃特世甲酸铵溶液(部件号186007081)溶于1 L水中,制得50 mM甲酸铵溶液。
|
LC系统: |
ACQUITY UPLC H-Class Bio ACQUITY UPLC H-Class PLUS Bio |
|
检测器: |
ACQUITY FLR,10 mm流通池,λ = 214 nm |
|
LC色谱柱: |
ACQUITY UPLC Glycan BEH Amide游离寡糖分析专用柱, 1.7 μm, 130Å, 2.1 mm × 150 mm(部件号186004742) |
|
柱温: |
60 °C |
|
样品瓶: |
12 × 32 mm全回收玻璃样品瓶(部件号600000750cv) |
|
进样体积: |
2 μL |
|
流动相A: |
50 mM甲酸铵,pH 4.4 |
|
流动相B: |
乙腈 |
|
时间(min) |
流速(min) |
%A |
%B |
|---|---|---|---|
|
初始 |
0.4 |
25 |
75 |
|
35 |
0.4 |
46 |
54 |
|
36.5 |
0.2 |
100 |
0 |
|
39.5 |
0.2 |
100 |
0 |
|
42.5 |
0.2 |
25 |
75 |
|
47.4 |
0.4 |
25 |
75 |
|
55 |
0.4 |
25 |
75 |
按照之前发表的应用纪要中所述的方法制备溶液2,磷酸二氢钠、磷酸氢二钠和氯化钠购自Sigma。将1.37 g磷酸二氢钠(一水合物)、2.70 g磷酸氢二钠(七水合物)、11.68 g氯化钠加入900 mL水中,并将pH调节至6.8,制得流动相20 mM磷酸盐缓冲液。然后将该缓冲液稀释至总体积1 L,用作流动相。将BEH200 SEC蛋白混标(部件号:186006518)完全溶于500 µL流动相中用于分析。
|
LC系统: |
ACQUITY UPLC H-Class Bio ACQUITY UPLC H-Class PLUS Bio |
|
检测器: |
ACQUITY TUV,10 mm流通池,λ = 214 nm |
|
LC色谱柱: |
ACQUITY UPLC BEH SEC蛋白分析专用柱, 200Å, 1.7 μm, 4.6 × 150 mm(部件号186005225) |
|
柱温: |
室温 |
|
样品瓶: |
12 × 32 mm全回收玻璃样品瓶(部件号600000750cv) |
|
进样体积: |
4 μL |
|
流动相: |
20 mM磷酸盐,200 mM NaCl,pH 6.8 |
|
流速: |
0.885 mL/min |
三氟乙酸(TFA)、LC-MS级水和乙腈购自FisherScientific。将Waters MassPREP烯醇酶酶解标准品(部件号186002325)复溶于100 µL流动相A(0.1% TFA水溶液)中,用作样品。
|
LC系统: |
ACQUITY UPLC I-ClassACQUITY UPLC I-Class PLUS |
|
检测器: |
ACQUITY TUV,10 mm流通池,λ = 214 nm |
|
LC色谱柱: |
ACQUITY UPLC BEH C18, 1.7 μm, 300Å, 2.1 mm × 100 mm(部件号186002350) |
|
柱温: |
65 °C |
|
样品瓶: |
12 × 32 mm全回收玻璃样品瓶(部件号600000750cv) |
|
进样体积: |
10 μL |
|
流动相A: |
0.1% TFA水溶液 |
|
流动相B: |
0.1% TFA的乙腈溶液 |
|
时间(min) |
流速(min) |
%A |
%B |
|---|---|---|---|
|
初始 |
0.200 |
99.0 |
1.0 |
|
3.00 |
0.200 |
99.0 |
1.0 |
|
88.00 |
0.200 |
50.0 |
50.0 |
|
90.00 |
0.200 |
10.0 |
90.0 |
|
100.00 |
0.200 |
10.0 |
90.0 |
|
102.00 |
0.200 |
99.0 |
1.0 |
|
126.00 |
0.200 |
99.0 |
1.0 |
作为一项关键质量属性(CQA),在生物药物开发过程中表征和监测糖基化分布的一致性对于确保产品安全性和疗效至关重要。游离寡糖分析工作流程广泛采用亲水作用色谱(HILIC),而由于生物药物的糖基化分布非常复杂,通常需要采用平缓的长梯度进行洗脱。因此,具有出色稳定性的LC仪器对于游离寡糖分析至关重要。
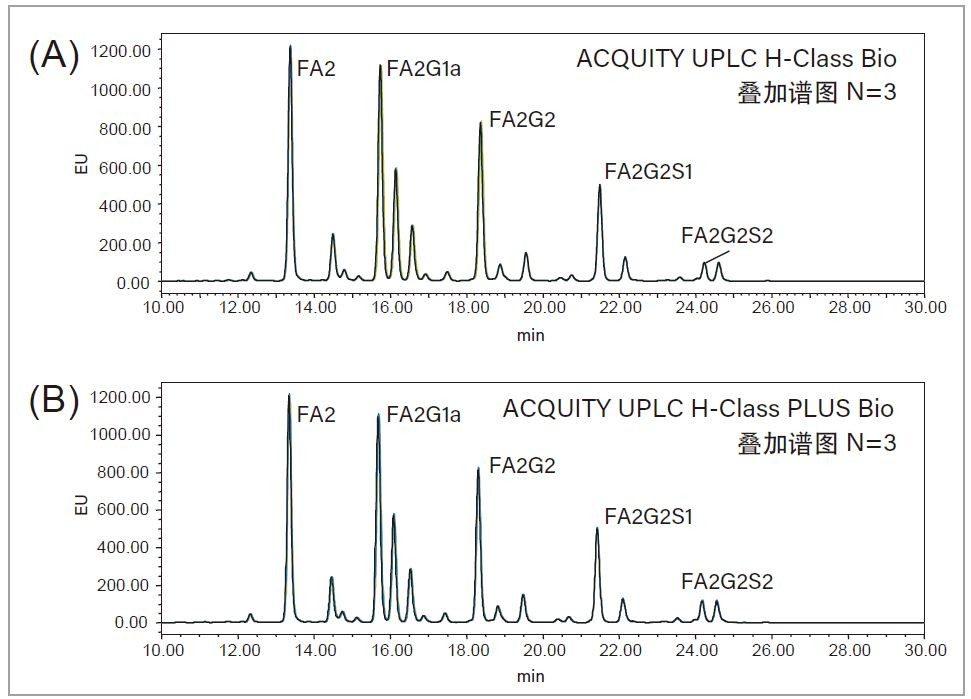
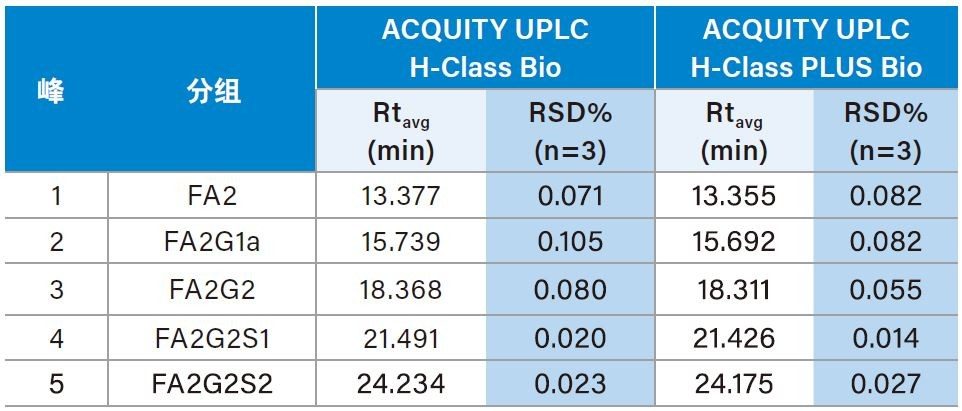
为了评估ACQUITY UPLC PLUS系统分析游离寡糖的性能,我们首先在传统ACQUITY UPLC H-Class Bio系统上采用15 cm的ACQUITY UPLC Glycan BEH Amide游离寡糖分析专用柱分离RapiFluor-MS游离寡糖性能测试标准品,将所得结果作为基准1, 采用35 min内乙腈从46%升至25%的梯度,所有游离寡糖都在20 min的洗脱窗口内得到了很好的分离,结果如图2A所示。接下来,在ACQUITY UPLC H-Class PLUS Bio系统上运行相同分析以比较结果。如图2B所示,所得分离结果与ACQUITY UPLC H-Class Bio系统相同,表1中记录的五个丰度最高的峰的保留时间与ACQUITY UPLC H-Class Bio系统得到的结果高度相似,证明两种LC系统具有等效性。此外,我们还根据三次连续进样的结果计算了这五个峰的保留时间%RSD,以此评估这两种系统的稳定性。如表1所示,ACQUITY UPLC H-Class PLUS Bio系统得到的保留时间%RSD (≤ 0.082%)系统地小于ACQUITY UPLCH-Class Bio系统得到的结果(≤ 0.105%),表明升级后的UPLC系统具有更出色的重现性。
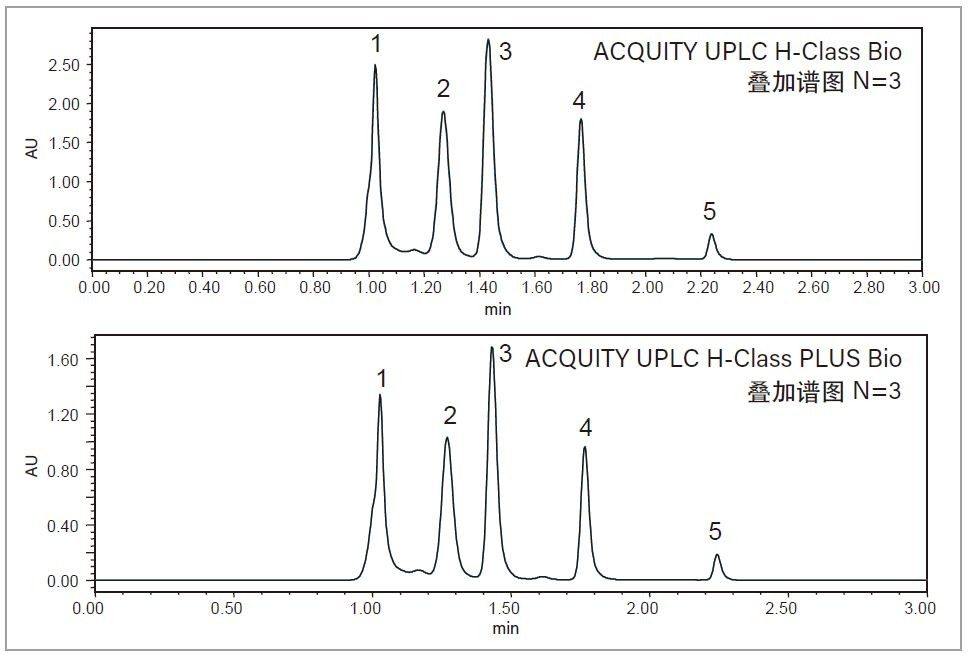
SEC被广泛用于生物药物表征和常规监测。SEC保留时间的重现性对于准确测定药物成分的聚集和碎裂情况至关重要。为了比较ACQUITY UPLC H-Class Bio系统和ACQUITY UPLC H-Class PLUS Bio系统的性能,本研究以SEC200蛋白质混标为样品,使用15 cm的ACQUITY UPLC BEH SEC蛋白质分析专用柱进行分离2。 如图3中的叠加色谱图(n=3)所示,五种组分在3 min内实现了很好的分离,并且两种仪器上各组分的保留时间几乎相同(表2),表明这两种系统具有等效性。表2还列出了这五个峰的保留时间%RSD,表明ACQUITY UPLC H-Class PLUS Bio系统在SEC应用中具有更高的重现性。
在生物药物开发过程中,将蛋白质酶解后进行肽图分析是表征和监测产品CQA的一种成熟方法。由于蛋白质的酶解位点和分子大小各不相同,所得酶解物可能会极为复杂,难以进行分离。在这种情况下,分析人员最担心的是可能会出现共流出的邻近洗脱峰,要想实现准确的峰鉴定和积分,保留时间必须具有极佳的重现性。
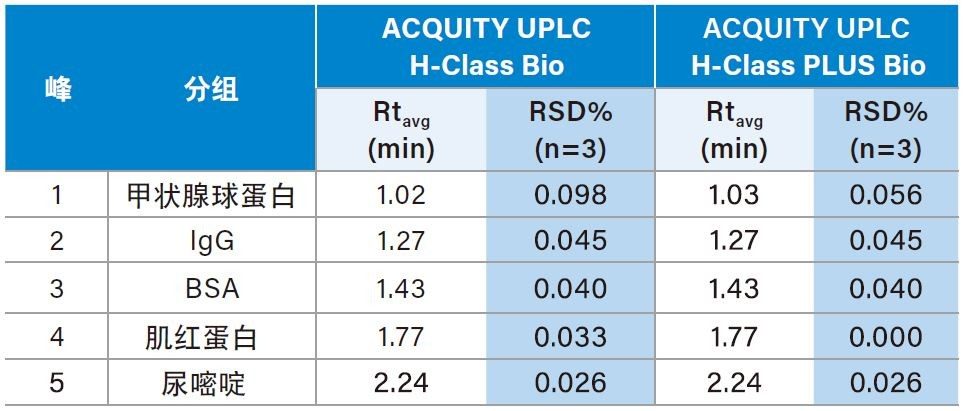
为了获得重现性最高的结果,我们选用具有二元泵和高压混合功能的ACQUITY UPLC I-Class系统对Waters MassPREP烯醇酶酶解标准品进行肽图分析。为确保最高覆盖率,本研究采用了乙腈在75 min内从1%升至50%的梯度,以期在实现高分离度的同时成功保留极性肽3。 如图4所示,两种系统得到了高度相似肽图分析谱图,表明ACQUITY UPLC I-Class PLUS系统完全可以替代传统ACQUITY UPLC I-Class系统。为了进一步比较仪器性能,我们选择了五个峰作为代表,测定整个梯度范围内的保留时间重现性。如表3所示,ACQUITY UPLC I-Class PLUS系统所得的保留时间%RSD明显低于ACQUITY UPLC I-Class系统(最大%RSD从0.044%降至0.014%),而平均保留时间保持相当。以上数据共同说明,ACQUITY UPLC I-Class PLUS系统具有与ACQUITY UPLC I-Class系统一致的分离性能,并且重现性更出色。
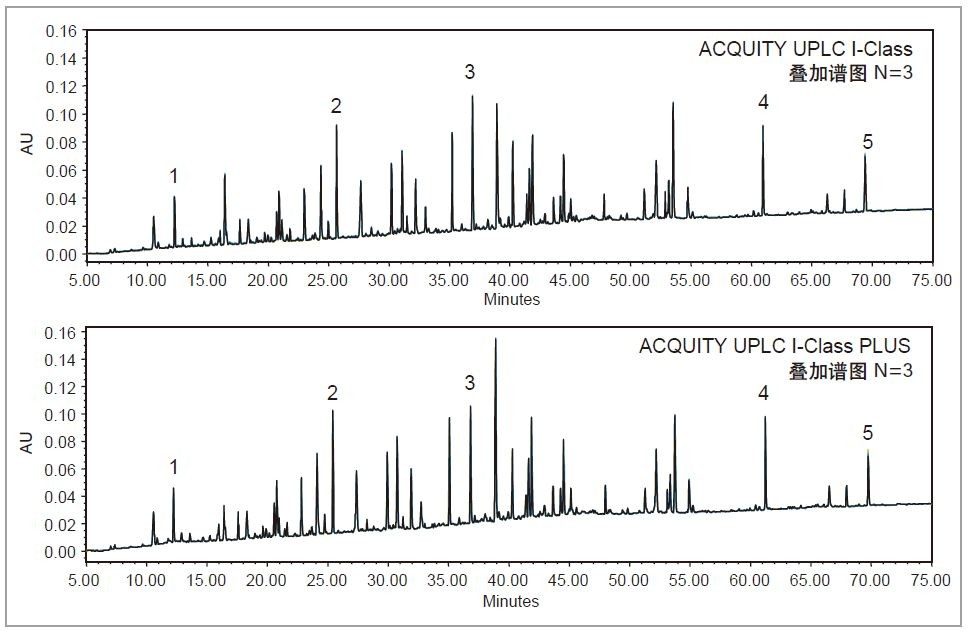
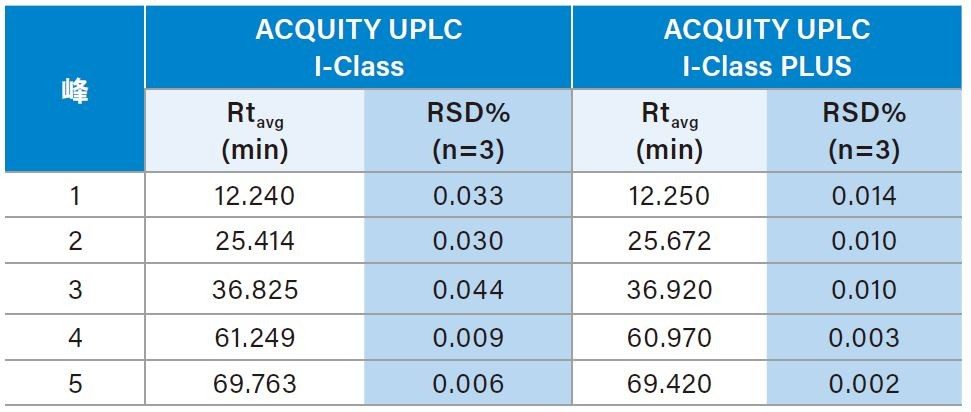
本研究使用生物药产品开发和生产中常用的技术比较了ACQUITY UPLC与ACQUITY UPLC PLUS系统的相似性和稳定性。在游离寡糖分析和SEC分析中,ACQUITY UPLC H-Class PLUS Bio系统在保持相同分离结果的同时降低了保留时间%RSD。在肽图分析中,ACQUITY UPLC I-Class PLUS系统所得的平均保留时间%RSD低于0.014%,这证明该系统还具有更出色的稳定性。综上所述,ACQUITY UPLC PLUS系统相具有与传统UPLC系统相当的分离性能,而重现性更出色,可用于改善生物制药应用的稳定性。
720006285ZH,2018年5月