利用系统化方案和MaxPeak高性能表面技术进行合成环肽和杂质的色谱分离方法开发
摘要
沃特世开发了一套系统化方案,详细信息请参阅Waters MaxPeak™ Premier反相色谱柱色谱分析方法包1。 接下来,使用搭载MaxPeak高性能表面(HPS)技术的Arc™ Premier系统和Premier色谱柱为一组环肽开发分析方法。结果表明,与传统不锈钢系统和色谱柱相比,使用这种先进技术能够改善分离效果。所得方法能够分离五种环状抗生素肽(奥利万星、达巴万星、卡泊芬净、达托霉素和阿尼芬净),获得可接受的性能。此外,我们还创建了一种将达巴万星与其相关杂质分离的方法。
优势
- 使用系统化方案缩短了方法开发时间
- 使用搭载MaxPeak HPS技术的Arc Premier系统和色谱柱提高了环肽的色谱峰性能和重现性
- 可靠且适应性强的Arc Premier系统,配备色谱柱管理器与QDa™质谱检测器,有助于扩大DOE实验规模并简化峰鉴定
简介
环肽因其独特的性质而备受关注。由于环肽没有自由的N端或C端,减少了蛋白酶降解,从而延长了它们在人体内的半衰期,用作治疗药物时可以减少给药频率2。 与线性肽相比,这些化合物的构象自由度降低,也提高了结合亲和力和特异性3。 相较于线性肽,环肽的另一个优势还在于它们能够形成分子内氢键,从而降低极性,使其更容易穿过细胞脂质双层。
抗生素自发现以来,已经挽救了无数人的生命,但这类化合物的频繁处方使用,导致耐药细菌变得更加普遍。在某些情况下,环肽类抗生素已被证明可以成功对抗特定和耐药菌株。达托霉素和达巴万星已被证明能够有效治疗耐甲氧西林葡萄球菌(MRSA)4。 近年来,MRSA的流行率有所增加,占全球血流感染的比例从2016年的21%增加到2020年的35%5。 最近,对这些环肽表现出耐药性的新型细菌菌株不断出现。随着人们对这些肽的兴趣日益浓厚,亟需更快速、更简化的方法。
近年来,“分析方法质量源于设计”(AQbD)已成为监管机构和制药行业关注的热点,AQbD的原则也逐渐被纳入监管指导中。为了加深对方法的理解并评估分析程序参数对分析的潜在影响,可以使用标准化、系统化的方案来开发方法。最近,沃特世针对肽分析应用的色谱方法开发发布了一套系统化方案。基于先前的知识、方法筛选以及通过使用系统化方法获得的知识进行风险评估,确保最终方法的质量和一致性。
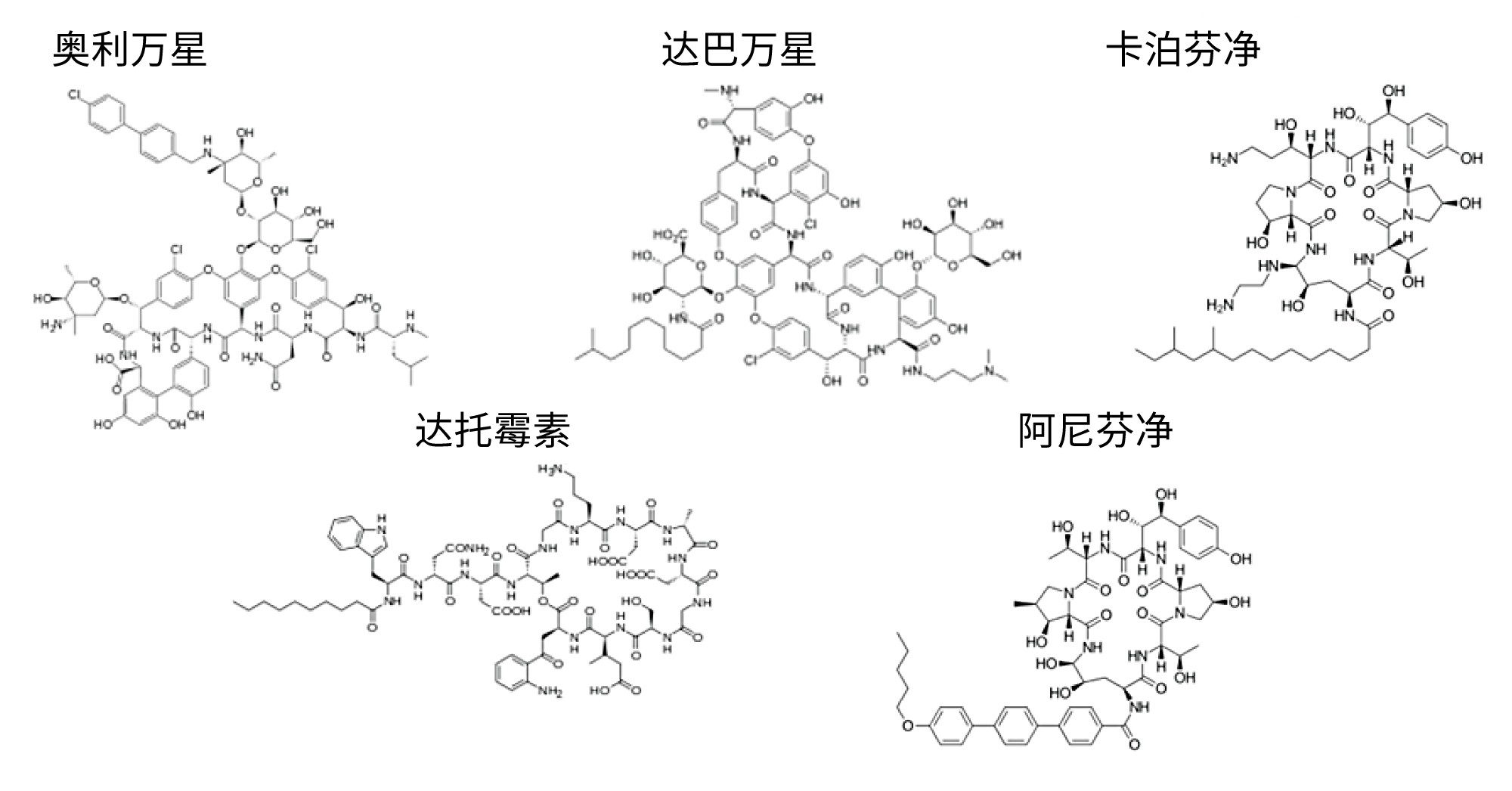
本应用纪要介绍了如何利用这种系统化方法开发策略创建一种分离图1所示五种环状抗生素肽的方法。 在成功开发出环肽检测组的分析方法后,我们创建了一种分离达巴万星杂质的方法。
实验
样品前处理和材料
单独的肽标准品购自Cayman Chemical(美国密歇根州);达巴万星杂质A40926购自Toronto Research Chemicals(加拿大安大略省)。使用100%二甲基亚砜(DMSO)制备标准品和样品,得到浓度均为0.1 mg/mL的奥利万星、达巴万星、卡泊芬净、达托霉素和阿尼芬净。杂质样品用100% DMSO制备,含有浓度为0.1 mg/mL的达巴万星和0.2 mg/mL的A40926。
液相色谱条件
|
液相色谱系统: |
Arc Premier QSM-r |
|
检测: |
PDA 2998@214nm |
|
样品瓶: |
1 mL全回收样品瓶,186000385DV |
|
色谱柱: |
XSelect™ Premier CSH C18 130 Å, 2.5 µm, 4.6 mm × 150 mm肽分析专用柱 |
|
柱温: |
肽检测组:60 ℃,达巴万星杂质:80 ℃ |
|
样品温度: |
20 °C |
|
进样体积: |
10 µL |
|
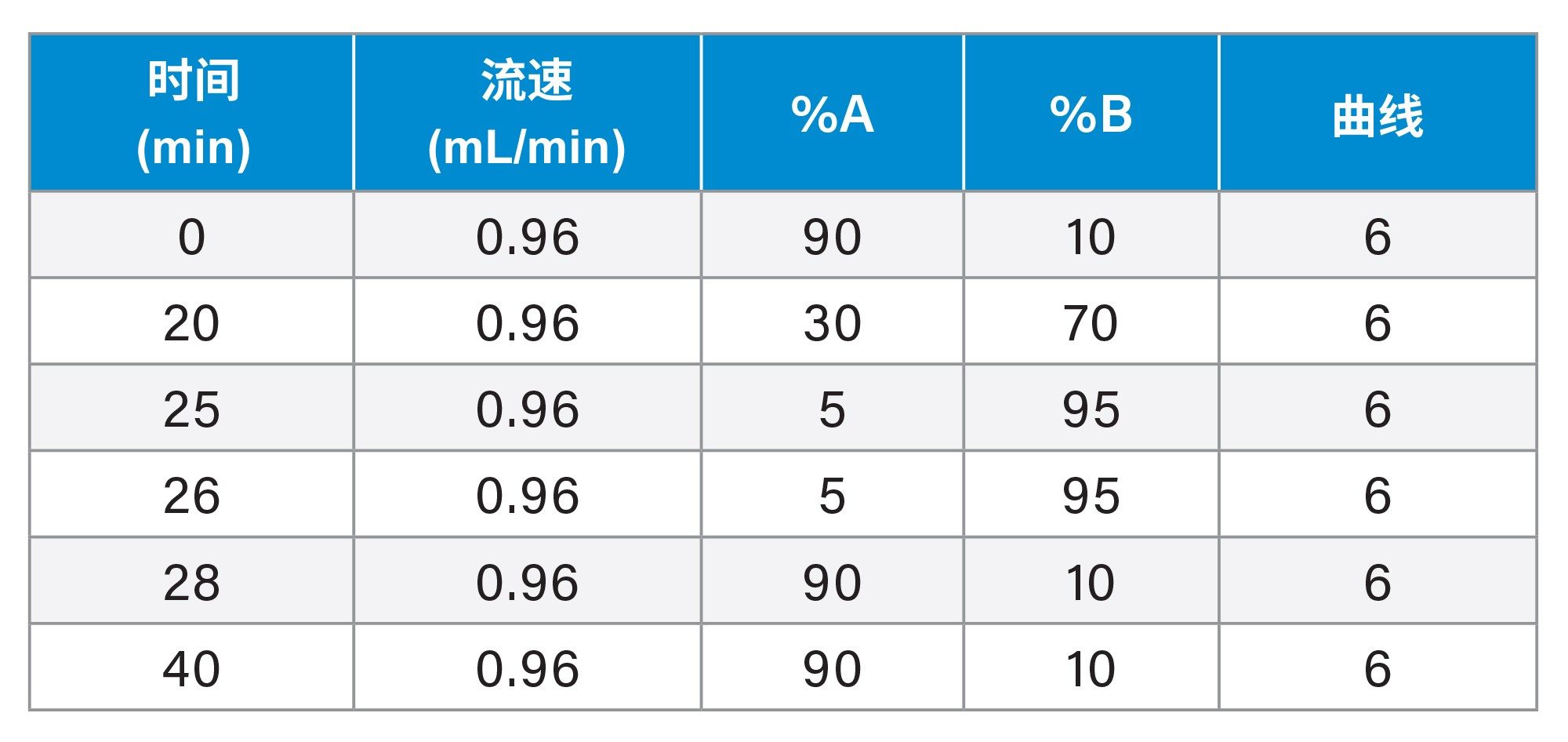
流速: |
0.96 mL/min |
|
流动相A: |
0.1%甲酸水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
检测组梯度
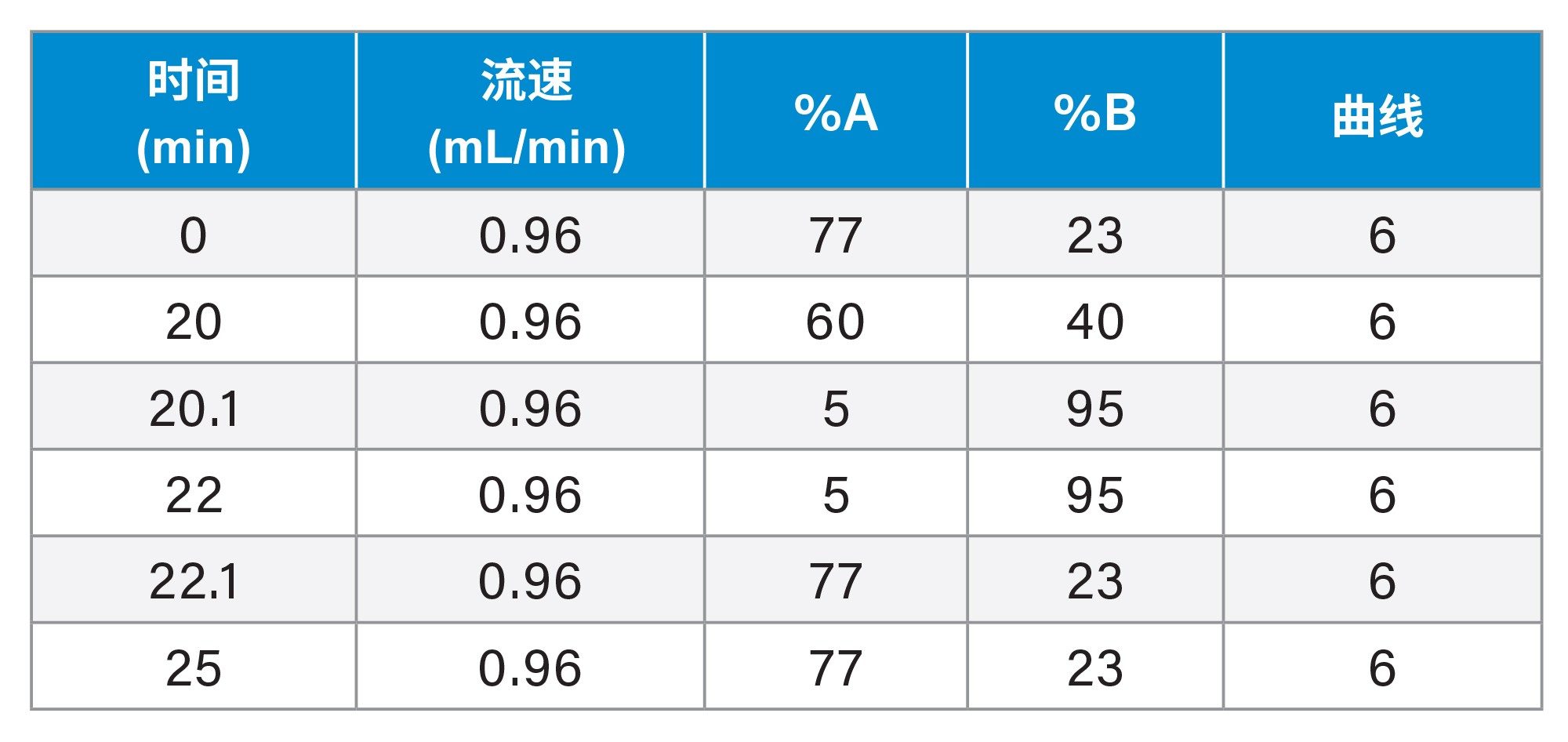
达巴万星杂质梯度
数据管理
|
色谱软件: |
Empower 3.6.2 |
结果与讨论
系统化方案和支持性研究有助于我们了解肽分析相关的各种风险。方案中最重要的考虑因素如下:
- 使用XSelect Premier CSH C18 (XSelect)肽分析专用柱和XBridge Premier BEH C18 (XBridge)肽分析专用柱。
- 在水相和乙腈流动相中均使用0.1%甲酸作为添加剂,随后使用0.1%三氟乙酸(TFA)。
- 筛选梯度为,在20分钟内从0.5%乙腈(ACN)增加至55% ACN。
- 聚焦梯度根据筛选梯度中分析物的洗脱时间创建。
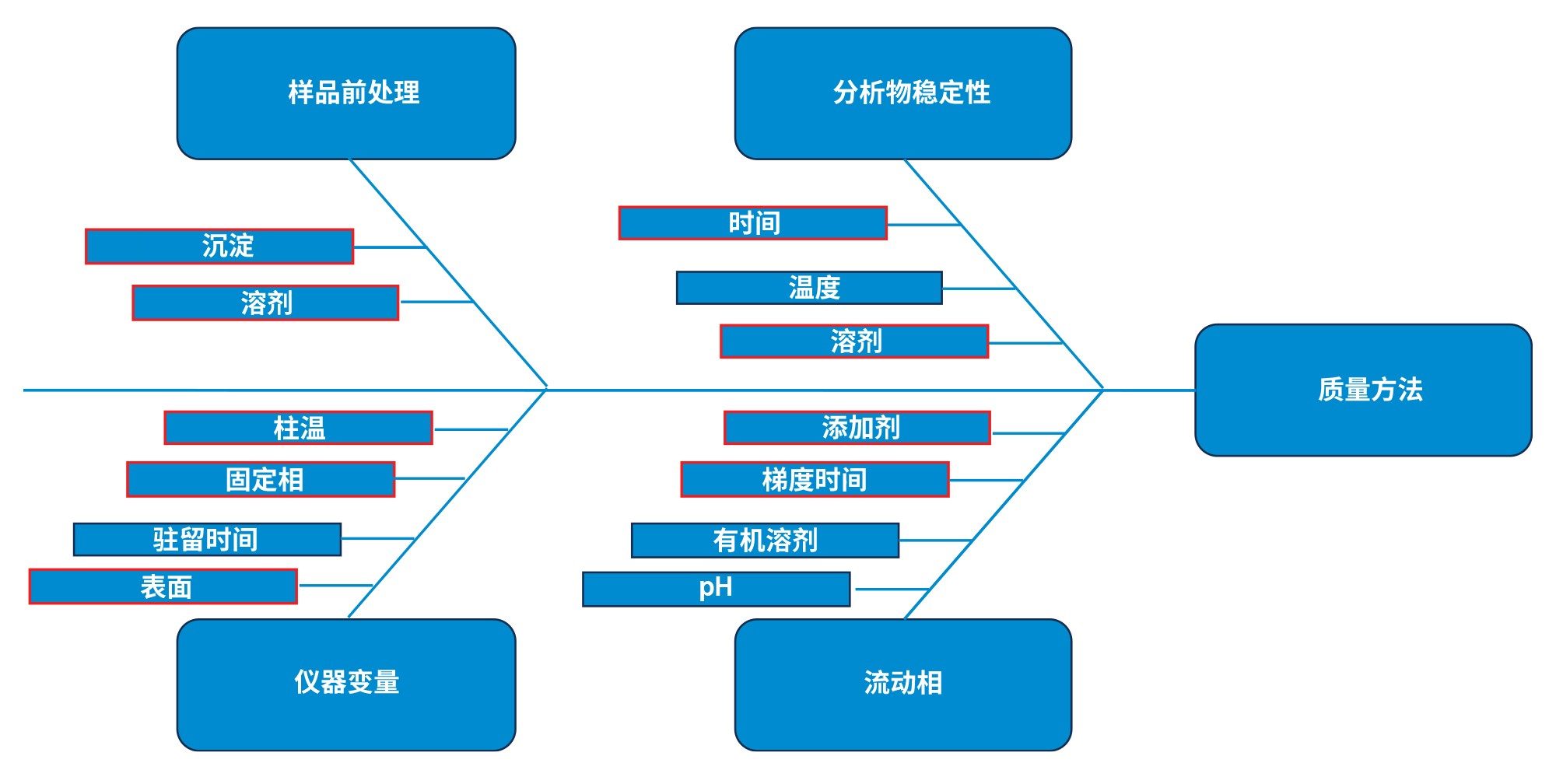
这四种色谱柱和洗脱液的组合在选择性和保留性方面存在差异,色谱峰形也存在差异。通过文献回顾和初始测试,本研究将这些变量确定为较高和较低风险。图2中的鱼骨图展示了确定的变量。
样品前处理和分析物稳定性
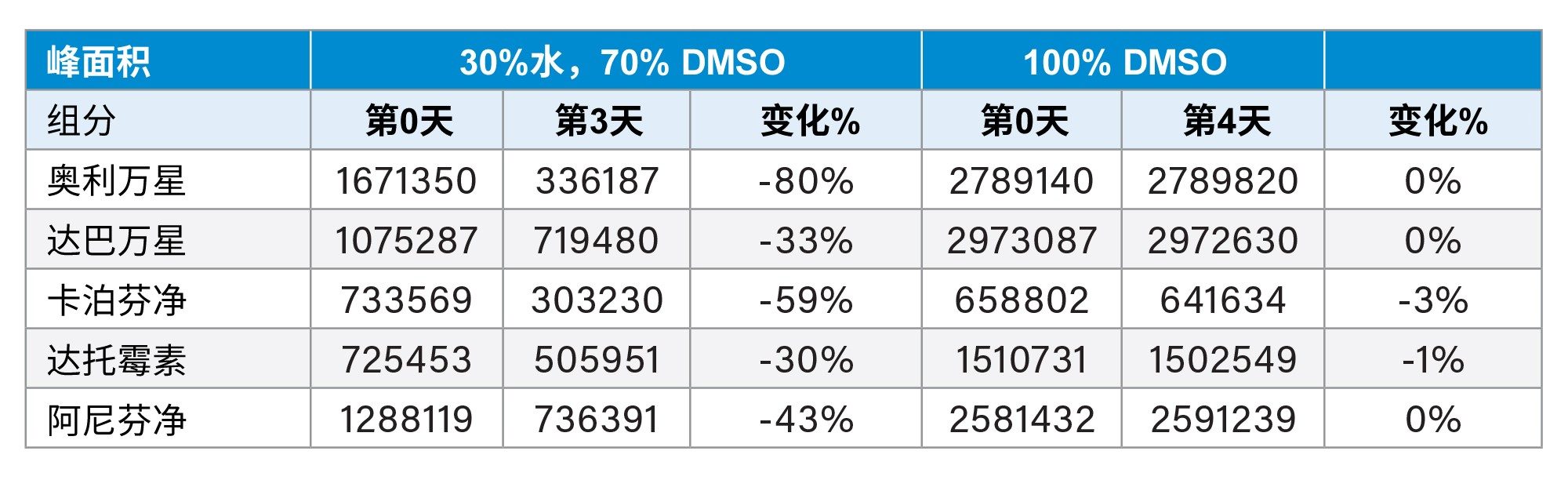
在方法开发过程中遇到的第一个高风险变量来自样品前处理。事实证明,样品溶解、沉淀和样品稳定性是一大挑战。每种肽用100% DMSO配制成1 mg/mL的储备液,并进一步稀释。值得注意的是,在0.1 mg/mL的样品浓度下,能够溶解样品的最高水相含量为30%水,其余70%为DMSO。而这种30%的水相溶剂被证明存在问题,因为观察到了快速降解(表1)。这一观察结果导致了样品前处理的改变。研究中还测试了较低水含量的流动相,但结果相似。最终发现100% DMSO的样品前处理效果最理想。这引入了强溶剂效应的可能性,但在最终方法中没有观察到峰分裂。
仪器变量和流动相
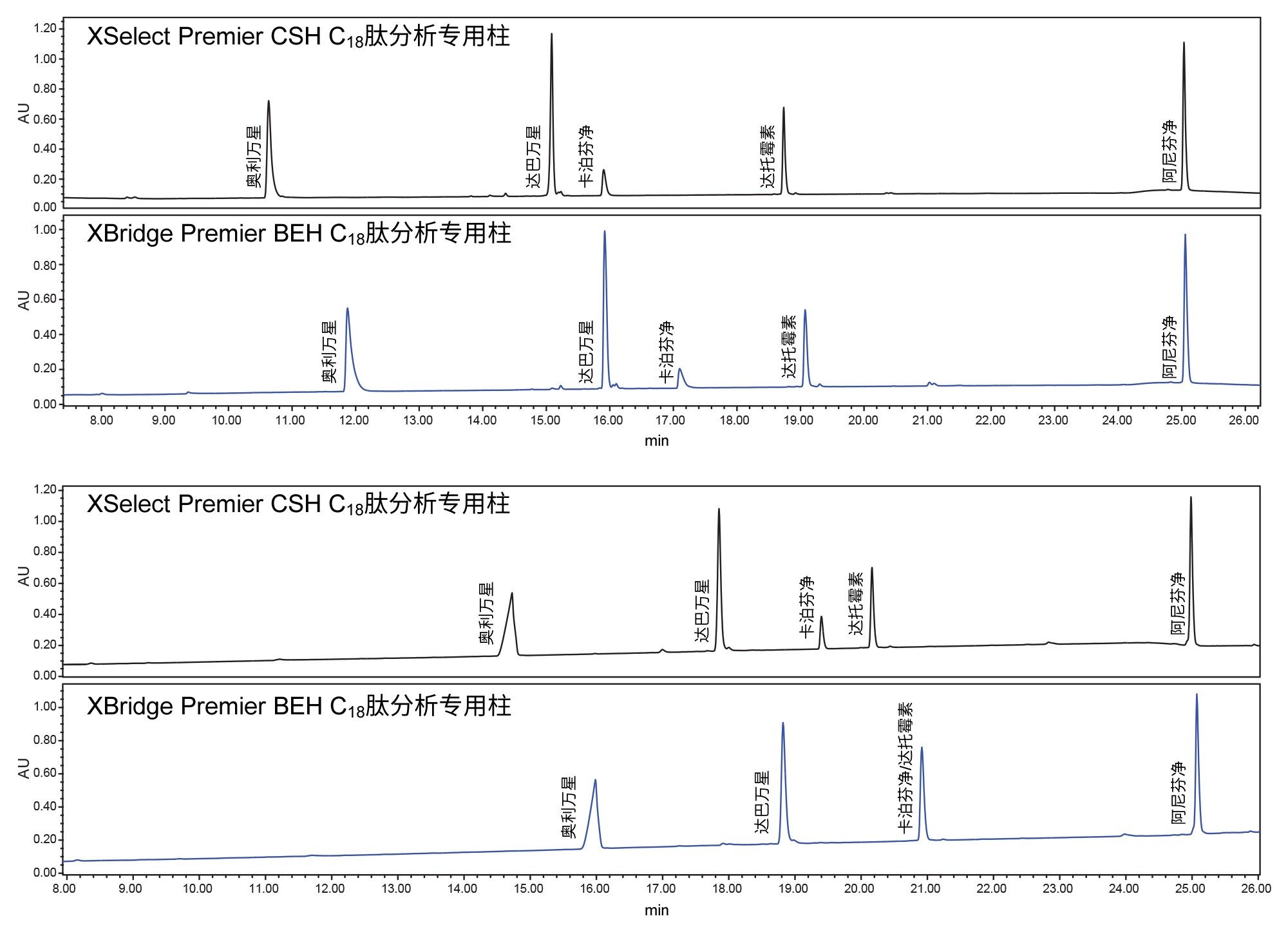
在研究样品稳定性问题时,使用新鲜制备的样品测试了四种不同的色谱柱和洗脱液添加剂组合。分析结果见图3,XSelect色谱柱的分离效果尤其出色。从底部的色谱图可以看出,使用XBridge色谱柱且流动相中有TFA添加剂,会导致达托霉素和卡泊芬净发生共洗脱,从而出现选择性差异。QDa质谱检测器可以轻松鉴定出色谱峰并确认共洗脱峰。
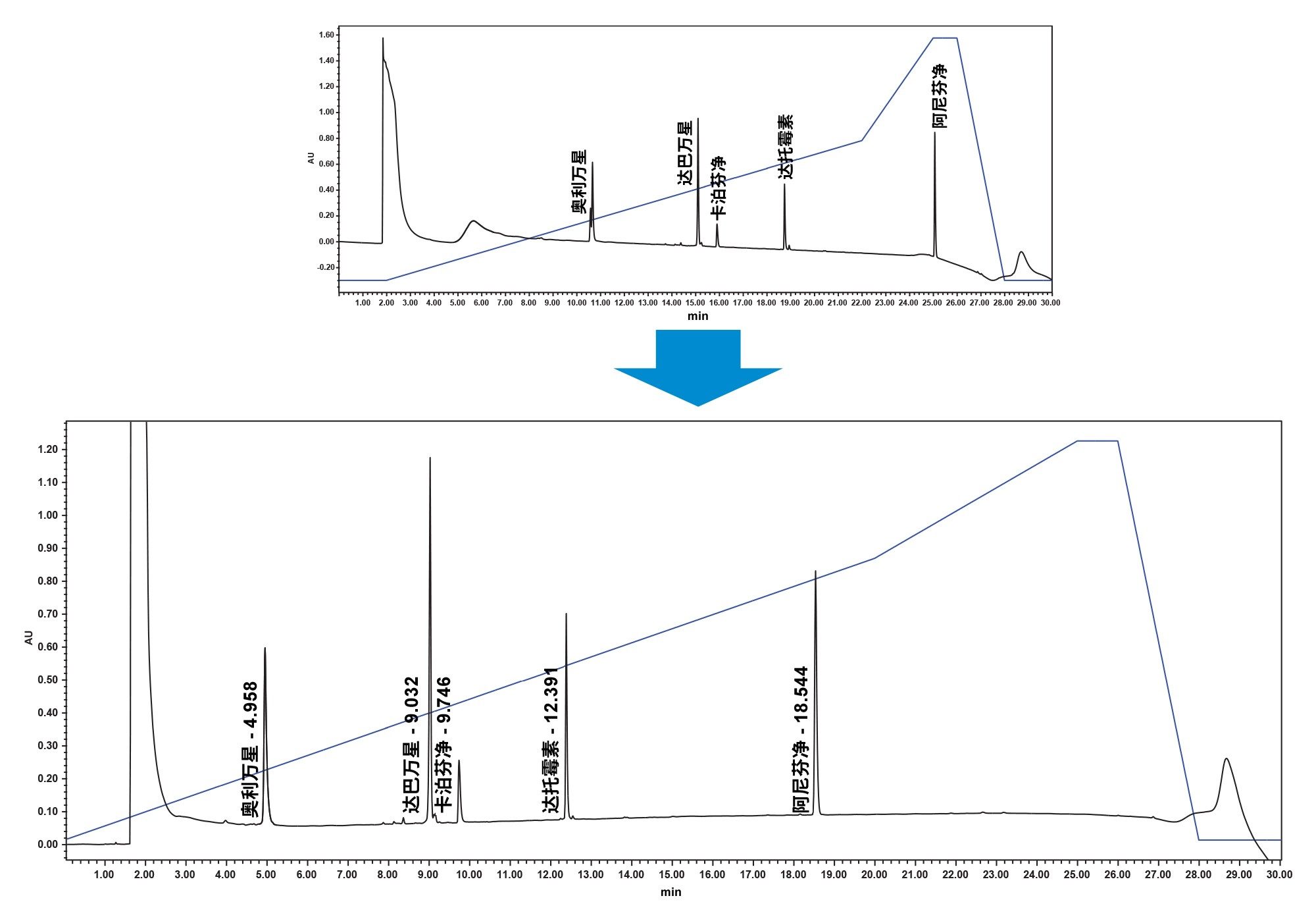
在筛选这四种组合时,发现色谱峰在梯度后期洗脱。第一个色谱峰,奥利万星,在运行10 min后洗脱,而最后一个洗脱峰,阿尼芬净,在缓慢的梯度清洗过程中洗脱。因此,将初始起点从0.5% ACNC调整为10% ACN,终点从55% ACN调整为70% ACN。起点改为10% ACN还意味着,与起始点0.5%ACN相比,强溶剂效应得以消除。执行此调整后,100% DMSO样品前处理变得可行。检测组分离的最终方法见图4。在这种新方法中,第一个峰在梯度中更早洗脱,最后一个峰在主梯度中洗脱,同时还改善了色谱峰特征。
利用MaxPeak技术降低风险
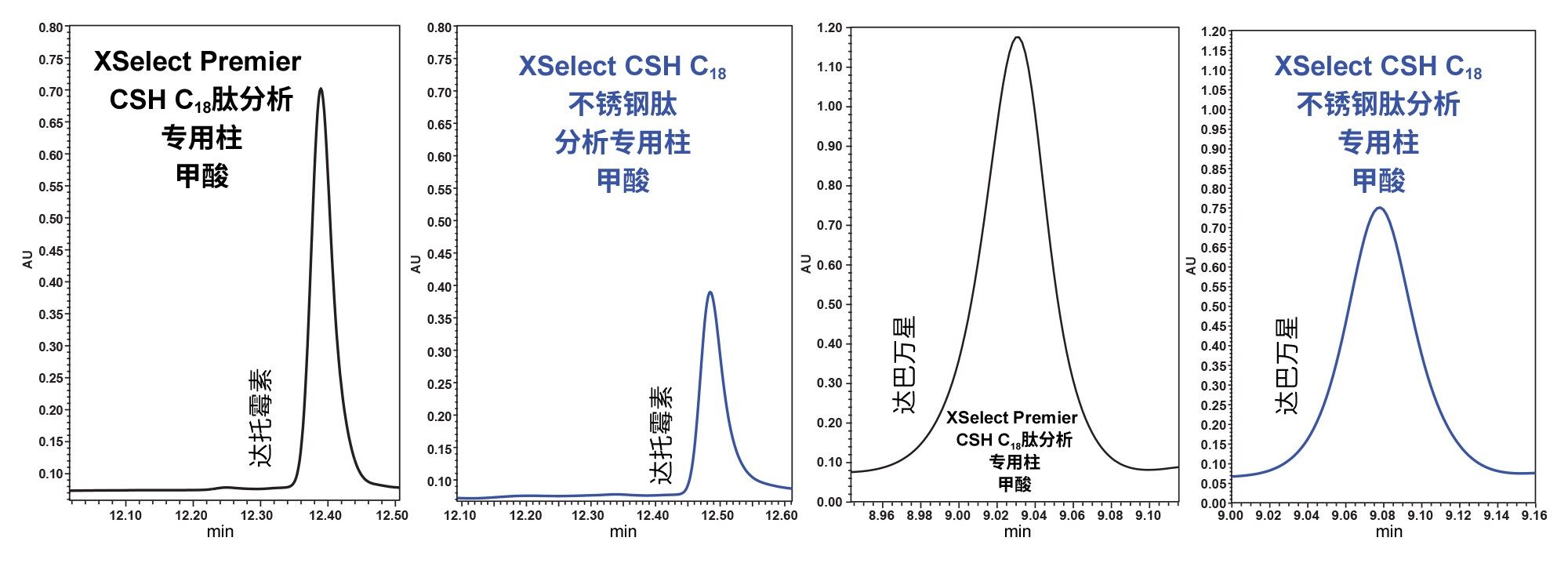
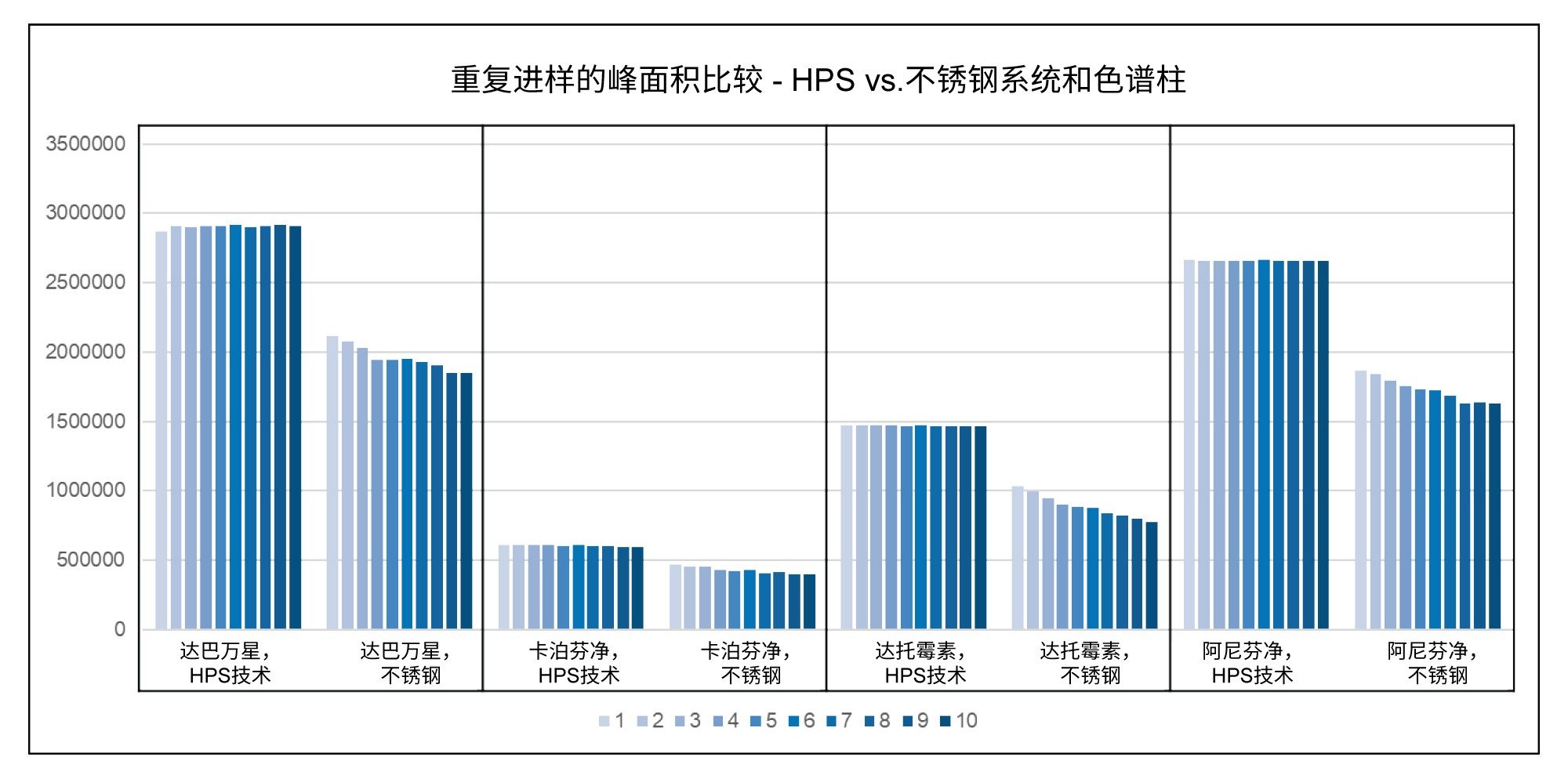
完成上述方法修改后,分别在两套系统上运行分析:一套是采用MaxPeak HPS技术的Arc Premier系统,另一套是采用传统不锈钢硬件的ACQUITY Arc系统。这两种硬件表面的比较特别受关注,因为这些化合物可能是路易斯碱,能吸附到不锈钢表面的金属氧化物上。这种吸附会导致色谱性能下降,如图5所示。与Arc Premier系统相比,在不锈钢系统上观察到峰高、峰形和峰面积均显著减小。
下面图6中的图表显示了Arc Premier和ACQUITY Arc系统十次重复进样的结果。这些图直观地显示了这些运行的相对标准偏差。与采用MaxPeak HPS技术的系统和色谱柱相比,传统不锈钢系统的重现性较差。请注意,这些运行是在未经钝化的系统和色谱柱上完成的。如果不锈钢系统用特定的流动相进行钝化,并进行牺牲分析物的进样,让分析物吸附到所有活性位点,其重现性可能会有所改善。而采用MaxPeak HPS技术则无需进行上述过程,因而降低了风险、节省了时间,并增加了有效进样的次数。
达巴万星杂质分析
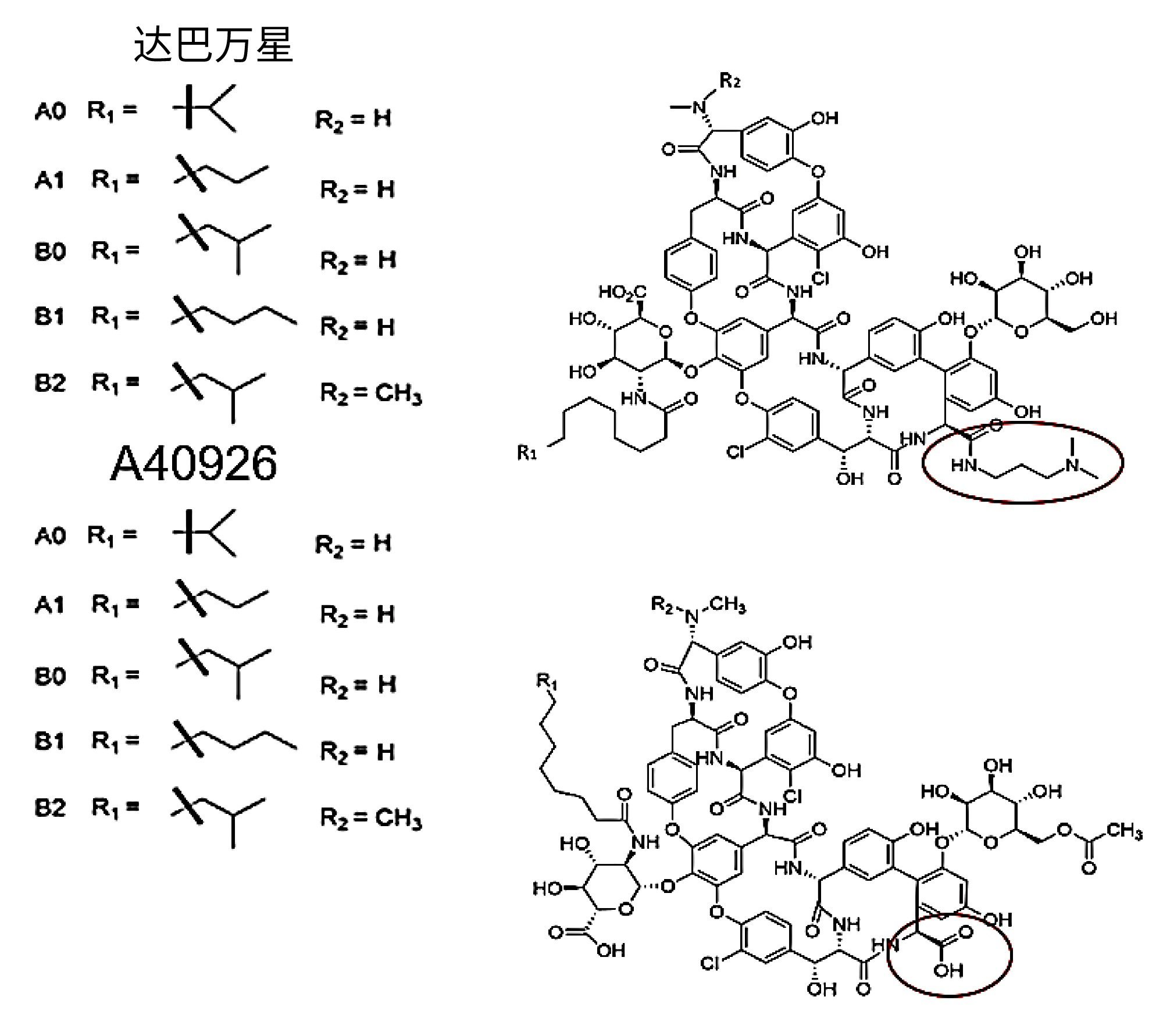
分析完这组环肽后,我们创建了一种分析达巴万星(一种具有抗革兰氏阳性菌活性的抗生素)杂质的方法。达巴万星是一种替考拉宁类似物,是肽段A40926的二甲胺丙基酰胺衍生物6。 达巴万星和A40926均主要由化合物B0组成,但也含有少量A0、A1、B1、B2等已知杂质,这些杂质在药物产品中允许存在,但仍需进行监测。我们使用这10种化合物创建了一个杂质检测组,然后创建了一种分离所有杂质与主要组分达巴万星B0的方法。这10种化合物的结构如图7所示。
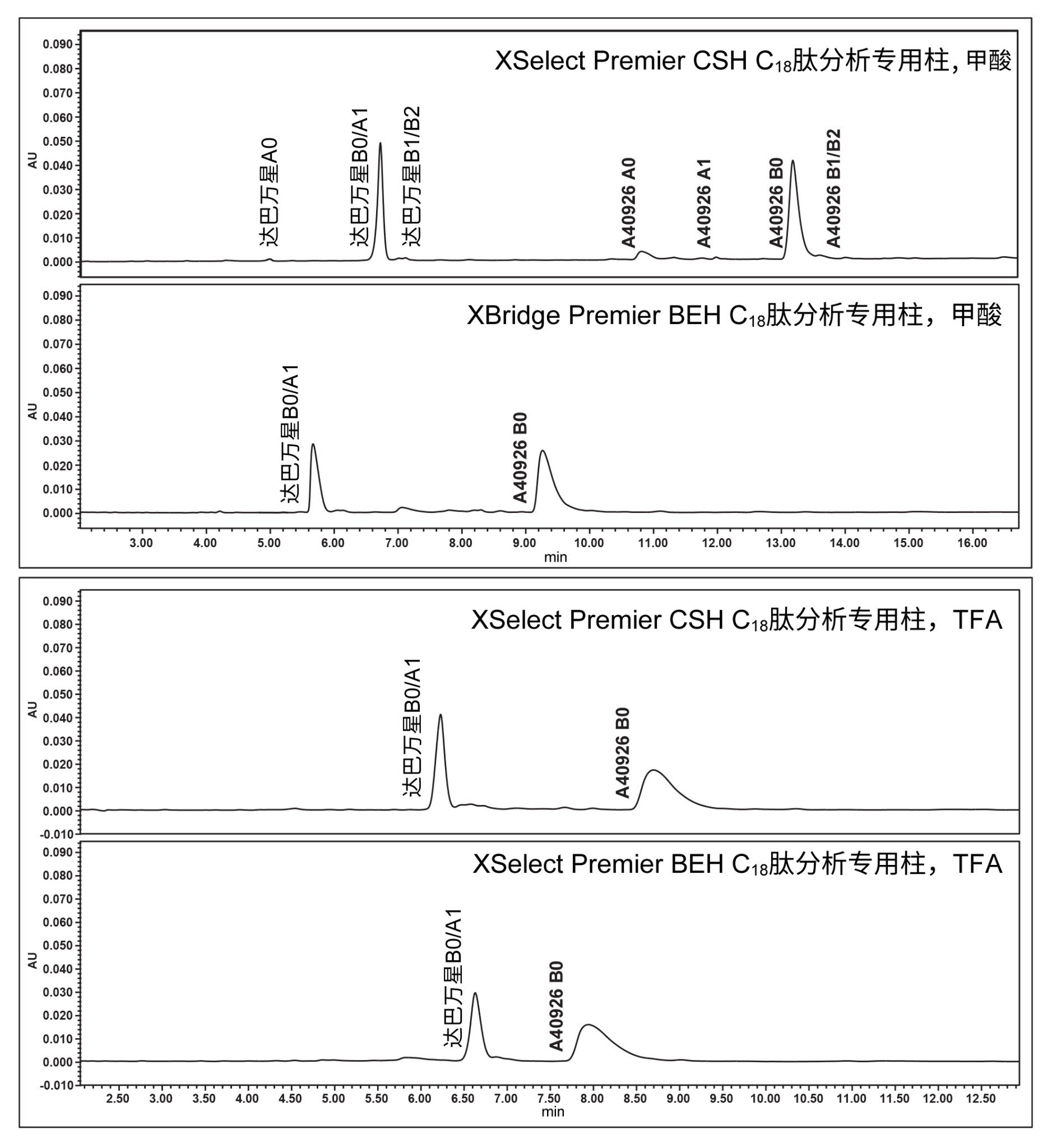
在图8中,每种色谱柱和流动相添加剂的组合都设计了特定的梯度,以便它们在色谱图中得到理想分离,并获得大致相同的保留时间。使用甲酸作为洗脱液添加剂的XSelect色谱柱表现最佳,使用QDa质谱检测器时在该色谱图中鉴定出所有10种化合物。其他组合未能实现所有化合物的分离和鉴定。
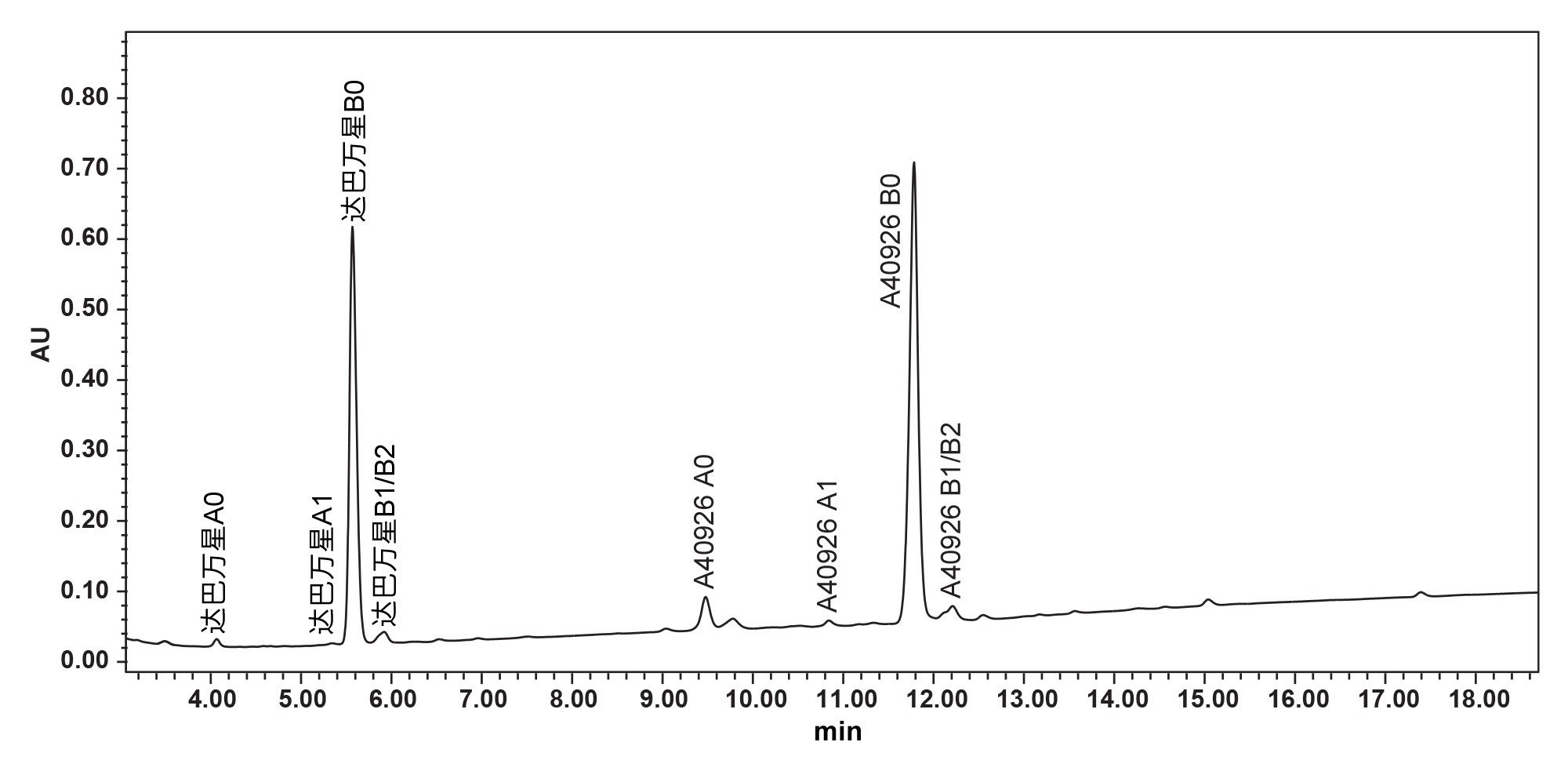
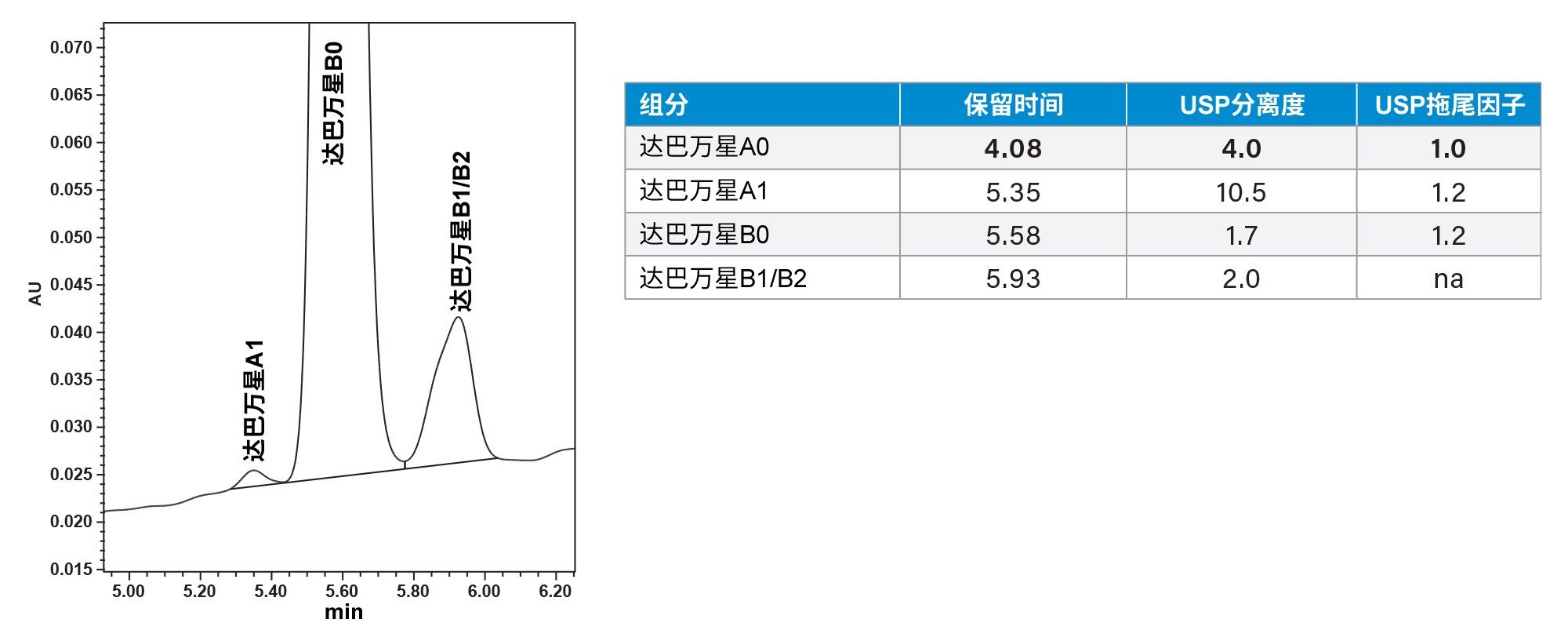
虽然XSelect色谱柱在图8的筛选运行中性能最理想,但仍然无法充分分离达巴万星A1与达巴万星B0。为了分离达巴万星B0与相关杂质(包括达巴万星A1),我们对4根色谱柱的梯度时间和温度进行了进一步优化。结果再次表明,XSelect在提供所需的分离结果方面仍然表现最佳。最终的方法参数包括80 °C柱温和本应用纪要开头部分梯度表(第3页)中所示的梯度。达巴万星B0与其他9种化合物完全分离(图9、10)。
结论
结果表明,Waters MaxPeak Premier反相色谱柱色谱分析方法包中概述的系统化方案是创建方法的理想起点。Premier系统和色谱柱中采用的MaxPeak HPS技术,与传统的不锈钢系统和色谱柱相比,可实现高达62%的色谱峰面积增加、67%的峰高增加,35%的峰拖尾减少,和9%的色谱峰面积相对标准偏差降低。
按照系统化方案,我们在Arc Premier系统上成功创建了一种分离一组5种环状抗生素肽(包括奥利万星、达巴万星、卡泊芬净、达托霉素和阿尼芬净)的HPLC方法。为进一步证明系统化方案的性能,进行了杂质分析,并稍微扩展了实验设计标准,结果表明,该方法能够从目标化合物达巴万星B0中分离出全部9种杂质。QDa质谱检测器是根据质荷比鉴定达巴万星中潜在杂质的有效工具。
参考资料
- MaxPeak™ Premier Peptide Reversed-Phase Columns and Method Screening Kit: Practical Steps in Developing Robust Peptide Separations Start Up Guide.Waters Corporation.User Manuals, 720008131, 2023.
- Van Bambeke F. Lipoglycopeptide Antibacterial Agents in Gram-Positive Infections: A Comparative Review.Drugs 2015;75: 2073–2095.DOI: 10.1007/s40265-015-0505-8
- Xiao P, Pei D. High-Throughput Synthesis and Screening of Cyclic Peptide Antibiotics.Journal of Medicinal Chemistry 2007; 50(13): 3132–3137.DOI: 10.1021/jm070282e
- Werth BJ, Jain R, Hahn A, Cummings L, Weaver T, Waalkes A, Sengupta D, Salipante SJ, Rakita RM, Butler-Wu SM.Emergence of Dalbavancin Non-Susceptible, Vancomycin-Intermediate Staphylococcus Aureus (VISA) After Treatment of MRSA Central Line-Associated Bloodstream Infection with a Dalbavancin- and Vancomycin-Containing Regimen.Clin Microbiol Infect.2018 Apr;24(4):429.doi: 10.1016/j.cmi.2017.07.028.
- World Health Organization.World Health Statistics 2023.World Health Organization, 19 May 2023, www.who.int/publications/i/item/9789240074323.
- N. Scheinfeld.Dalbavancin: A Review for Dermatologists.Dermatology Online Journal, 2006 12(4).DOI: 10.5070/D30wn7d4q9
720008273ZH,2024年3月