利用MaxPeak™高性能表面(HPS)改善合成肽类药物恩夫韦肽和HAART药物的分析
摘要
HIV是一种每年影响数百万人的病毒。如果不及时治疗,可能会发展为AIDS,导致感染者的免疫力进一步受损,易受各种疾病和癌症侵害。AIDS每年夺去了数十万人的生命,而针对HIV的治疗选择已经取得了进展。这些治疗方法包括HAART联合合成肽类药物(如恩夫韦肽)。
为了满足人们对快速、现代化,且能够分离现行HIV治疗标准品的分析方法的需求,我们开发了一种线性、可重现的HPLC-UV/MS方法,可在6分钟内完成分离。此外,我们还展示了与传统不锈钢系统相比,使用MaxPeak HPS进行合成肽分析的优势。
优势
- 与传统的不锈钢系统相比,MaxPeak HPS显示出更高的重现性
- Max Peak HPS可增加恩夫韦肽的信号峰面积和峰高,从而降低了定量下限
- 我们开发出了一种方法,可同时定量HAART和恩夫韦肽,且运行时间比之前的方法快了近四倍
简介
人类免疫缺陷病毒(HIV)影响着全球数千万年轻人和老年人1。 如果不及时治疗,HIV可能会进展为获得性免疫缺陷综合征(AIDS),这种疾病会破坏感染者的免疫系统,使他们容易受到各种其他疾病和癌症的侵害2,3。 虽然HIV或AIDS目前无法治愈,但HIV的治疗已经取得了长足的进步。目前,HIV患者可以使用多种高效抗逆转录病毒治疗(HAART)药物,通常需要联合不同的抗逆转录病毒药物使用,以针对每个患者获得理想的治疗效果4,5。 如果患者对HAART治疗无反应,医生有时会开具另一种药物来改善预后。恩夫韦肽就是可以与HAART药物联合使用的候选药物之一6。 与抗病毒药物不同,恩夫韦肽不是小分子物质,而是一种合成肽7。
由于恩夫韦肽总是与其他药物联合使用,因此在现行的标准治疗中,含有HAART药物的溶液中恩夫韦肽的定量和分离至关重要。本应用纪要介绍了一种利用HPLC-UV/MS实现的线性、可重现方法,其中涵盖了包括恩夫韦肽在内的现有HAART组。多药分析方法的理念并不新颖,但据我们所知,目前可用于分离和定量HAART的方法中,还没有一种方法已经更新到可以包括恩夫韦肽8,9。 此外,其他方法需要花费近20分钟才能完全分离一组HAART,而在这里,我们在不到6分钟即可完成分离。此外,研究表明,Waters™ HPS可以减少一些金属与肽的不良相互作用,从而避免色谱响应降低10。
实验
制备标准储备液
恩夫韦肽乙酸盐购自Sigma Aldrich(密苏里州圣路易斯)。多替拉韦和比克替拉韦购自Selleck Chem(德克萨斯州休斯顿)。替诺福韦、拉米夫定、恩曲他滨和硫酸阿巴卡韦购自Cayman Chemical(密歇根州安阿伯)。储备液浓度因溶解度和所购物质的数量而异(表1)。制备过程中考虑了任何盐因素。有时会通过超声处理来帮助溶液中标准品的溶解。
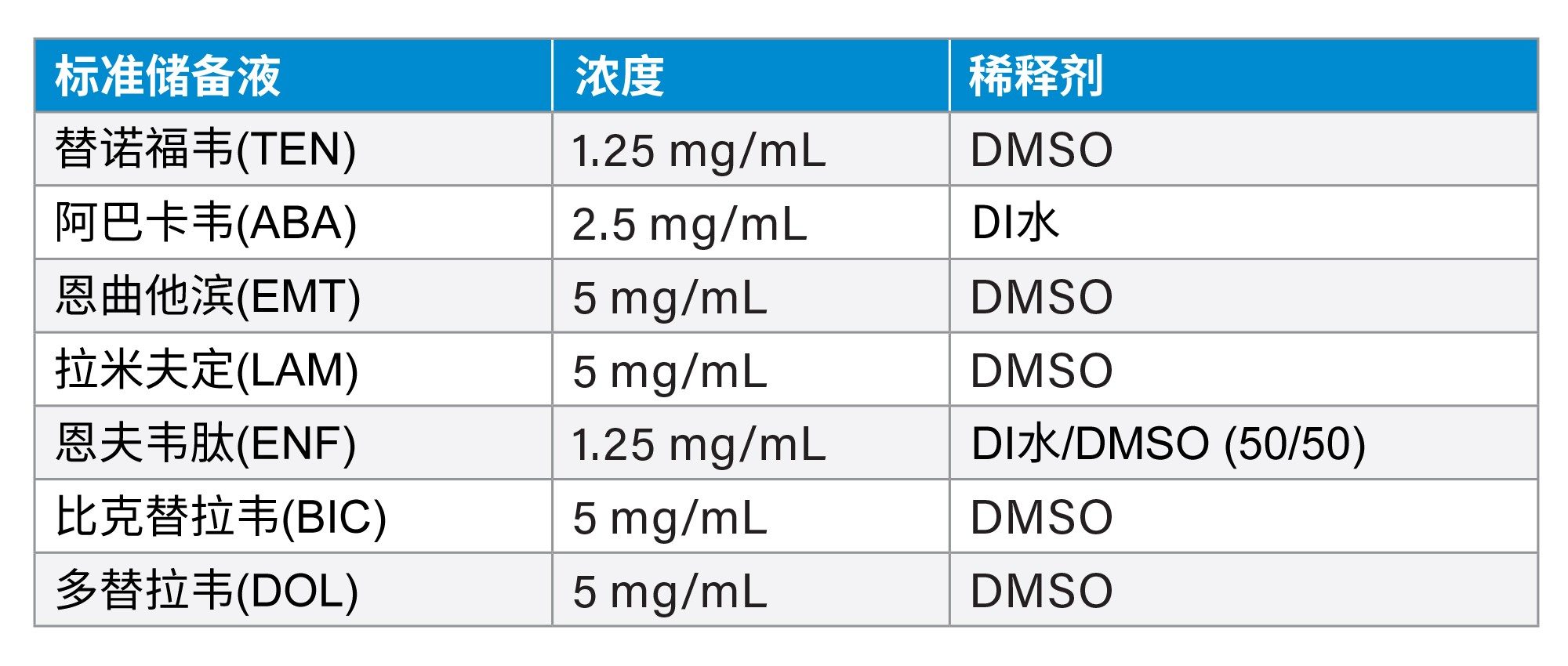
DI水是去离子水。DMSO是二甲基亚砜。
储备液储存于2~8 °C下。鉴于DMSO的物理特性,储备液在冷藏环境下为凝固状态。制备标样之前,将解冻的储备液平衡至环境室温。
制备系统适应性标样:
使用含5%乙腈(ACN)的DI水溶液稀释储备液。混合配制储备液,使所有分析物的浓度均为100 µg/mL(HIV药物混标)。
此外,我们还制备了一份仅含恩夫韦肽的标准品,来单独考察对合成肽的方法性能。该标准品的制备使用含5%乙腈的DI水溶液稀释恩夫韦肽标准品至浓度为100 µg/mL(恩夫韦肽适应性标准品)。
制备线性和限制标准品:
使用5%乙腈稀释剂制备浓度为250 µg/mL的HIV药物混标(不包括恩夫韦肽)。使用含5%乙腈的DI水溶液对标准品进行后续稀释,针对混合物中的每种HIV抗逆转录病毒药物制定多个校准点。
实验中为恩夫韦肽绘制了单独的标准曲线。首先使用含5%乙腈的DI水溶液制备浓度为1000 µg/mL的恩夫韦肽标准品,以建立恩夫韦肽标准曲线标准品。使用含5%乙腈的DI水溶液对该标准品进行后续稀释,建立恩夫韦肽的多个校准点。
该标准品也用于制备定量限(LOQ)标准品,用于比较MaxPeak HPS系统与传统不锈钢系统。
方法条件:
由于肽和抗逆转录病毒药物的UV吸光度不同,因此使用两种波长进行分析6,11。 对于恩夫韦肽的所有定量分析,使用214 nm波长,而对于抗逆转录病毒药物的定量数据,则使用260 nm波长。
LC条件
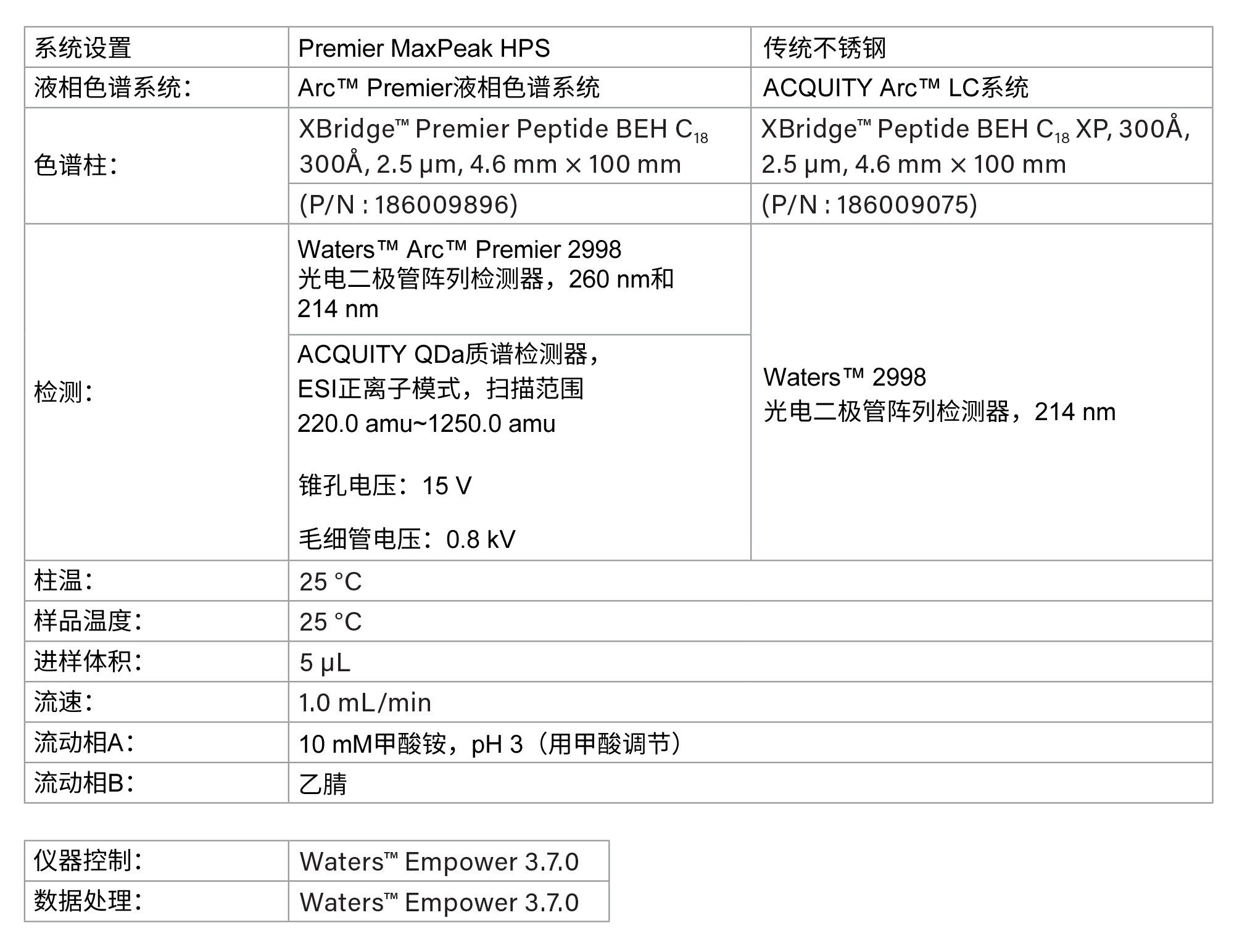
梯度表
结果与讨论
分离方法的结果:
该方法在6次进样中使HIV药物混标的保留和分离表现出良好的重现性。在260 nm波长下,HIV药物混标中抗逆转录病毒药物的峰面积和保留时间%RSD均<1%(表2和表3)。在214 nm波长下,HIV药物混标中恩夫韦肽的峰面积和保留时间%RSD均≤1%(表4和表5)。
比克替拉韦(BIC)与多替拉韦(DOL)之间的平均分离度为1.3,但由于BIC和DOL通常不在HIV治疗中联合使用,因此这不应影响联合治疗的准确分析5,12。 图1a和1b展示了在260 nm和214 nm下,6次进样的叠加色谱图,清晰展示了该方法的性能。在214 nm下,恩夫韦肽峰的响应较大。基线漂移是由分级梯度和流动相相关背景噪音增加共同导致的,这种现象在较低波长时较为常见。此外,这些色谱图证明了使用正确波长进行分析的重要性。
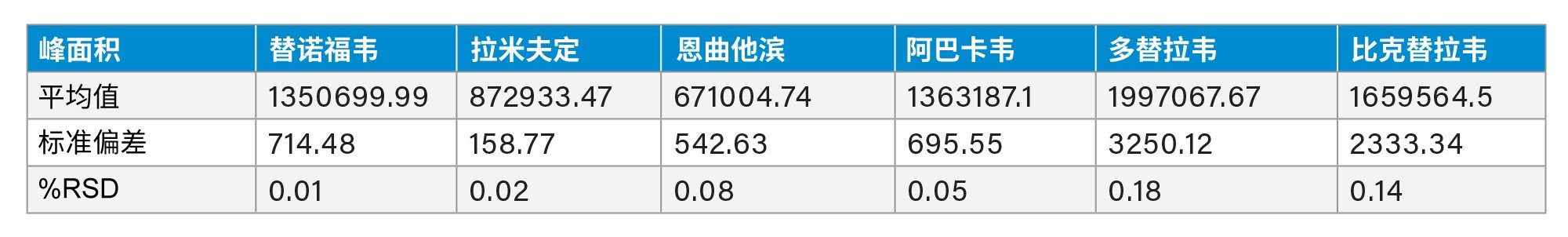
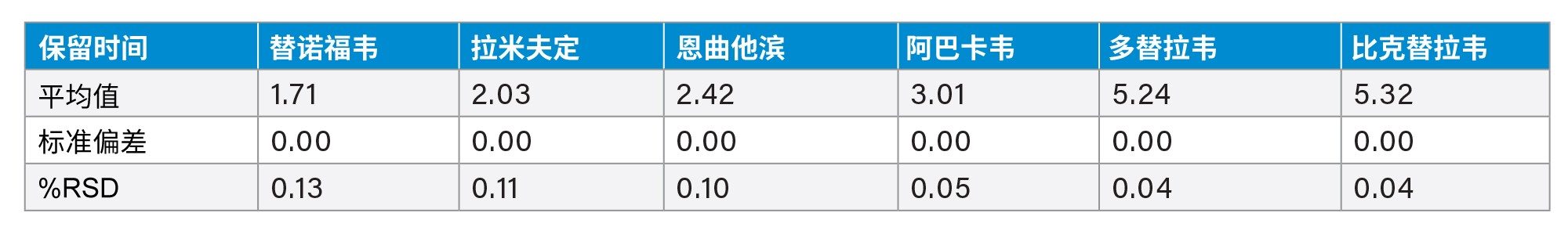
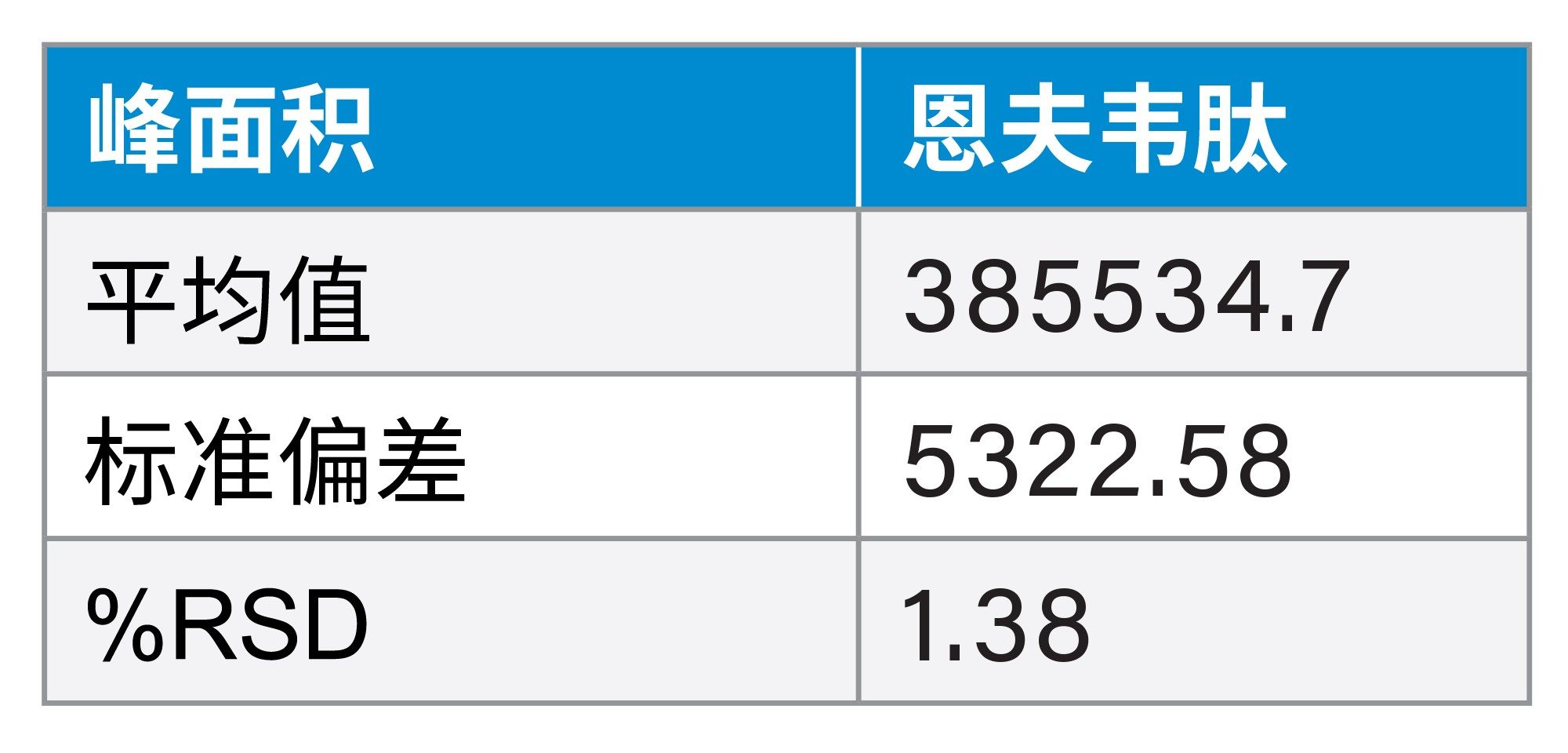
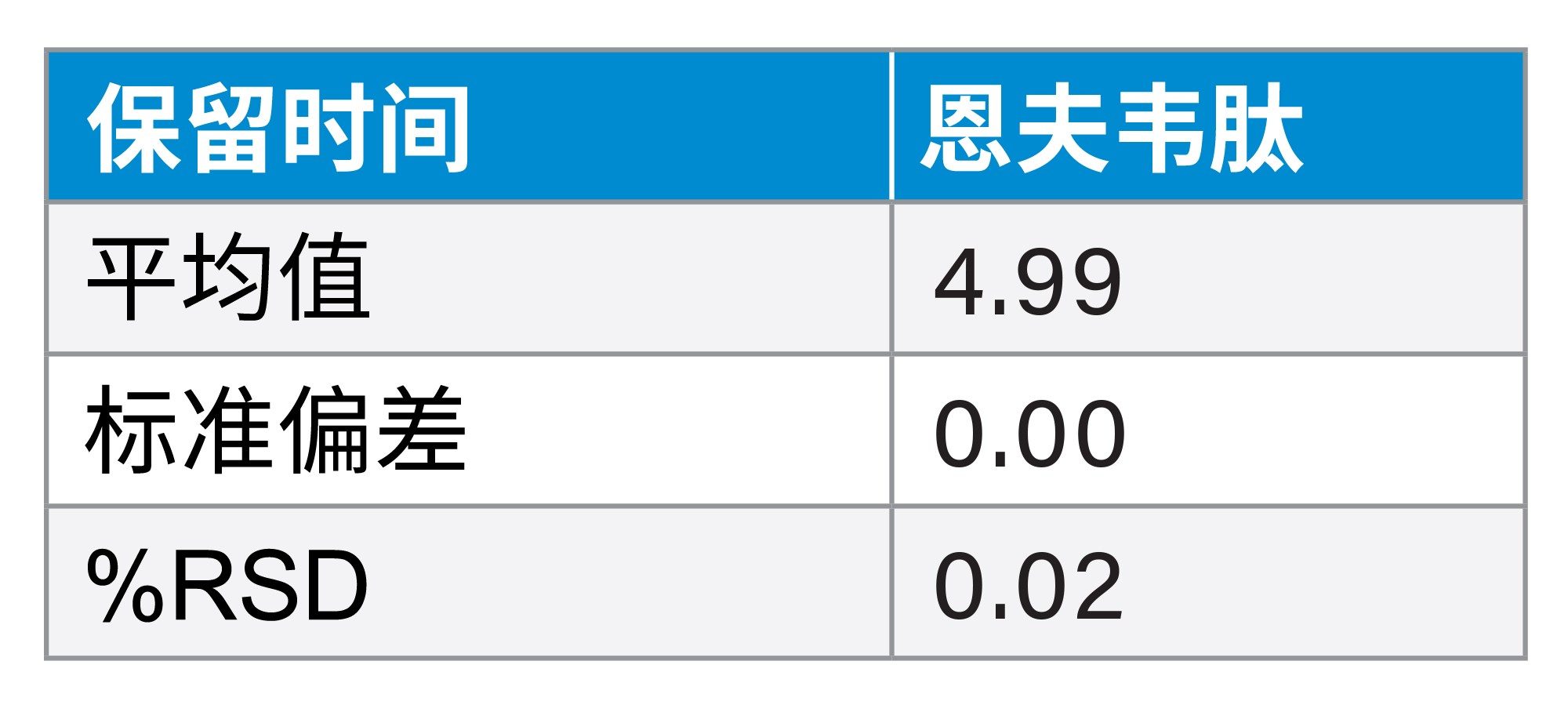
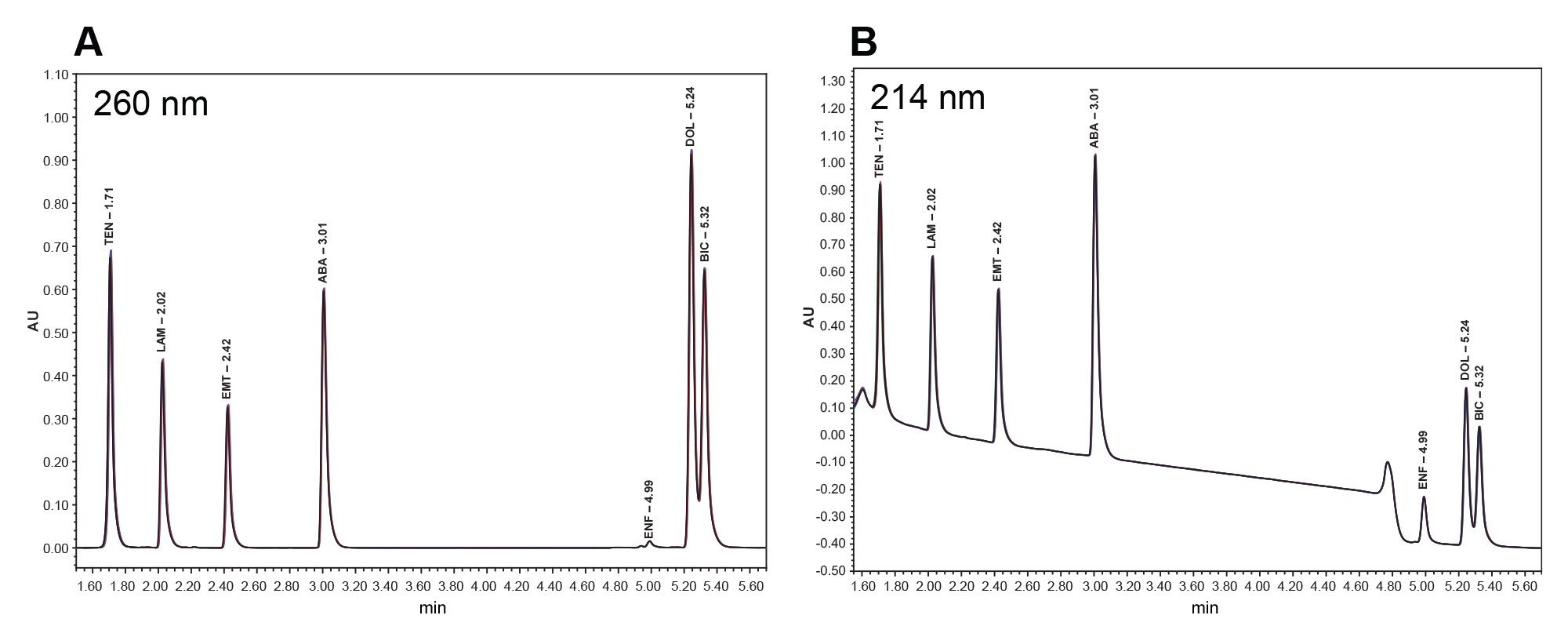
图1b.在214 nm波长下,6次进样HIV药物标准品的叠加色谱图。有关缩写的列表,请参见表1。
恩夫韦肽的质谱分析:
虽然恩夫韦肽可以通过UV检测器检测到,但为了辅助鉴定恩夫韦肽,我们还进行了质谱分析。恩夫韦肽的分子量为4492 g/mol7。 虽然其名义质量数已高于ACQUITY QDa质谱检测器的检测限,但恩夫韦肽有一个主要离子在1124 m/z,这意味着,当合成肽相对于其质荷比(m/z)带有4个电荷时能够被检测到13,14。 下面的叠加色谱图展示了HIV药物标准品的UV和总离子流色谱图(TIC),以及恩夫韦肽的选择提取离子流色谱图(XIC)(图2a到2c)。
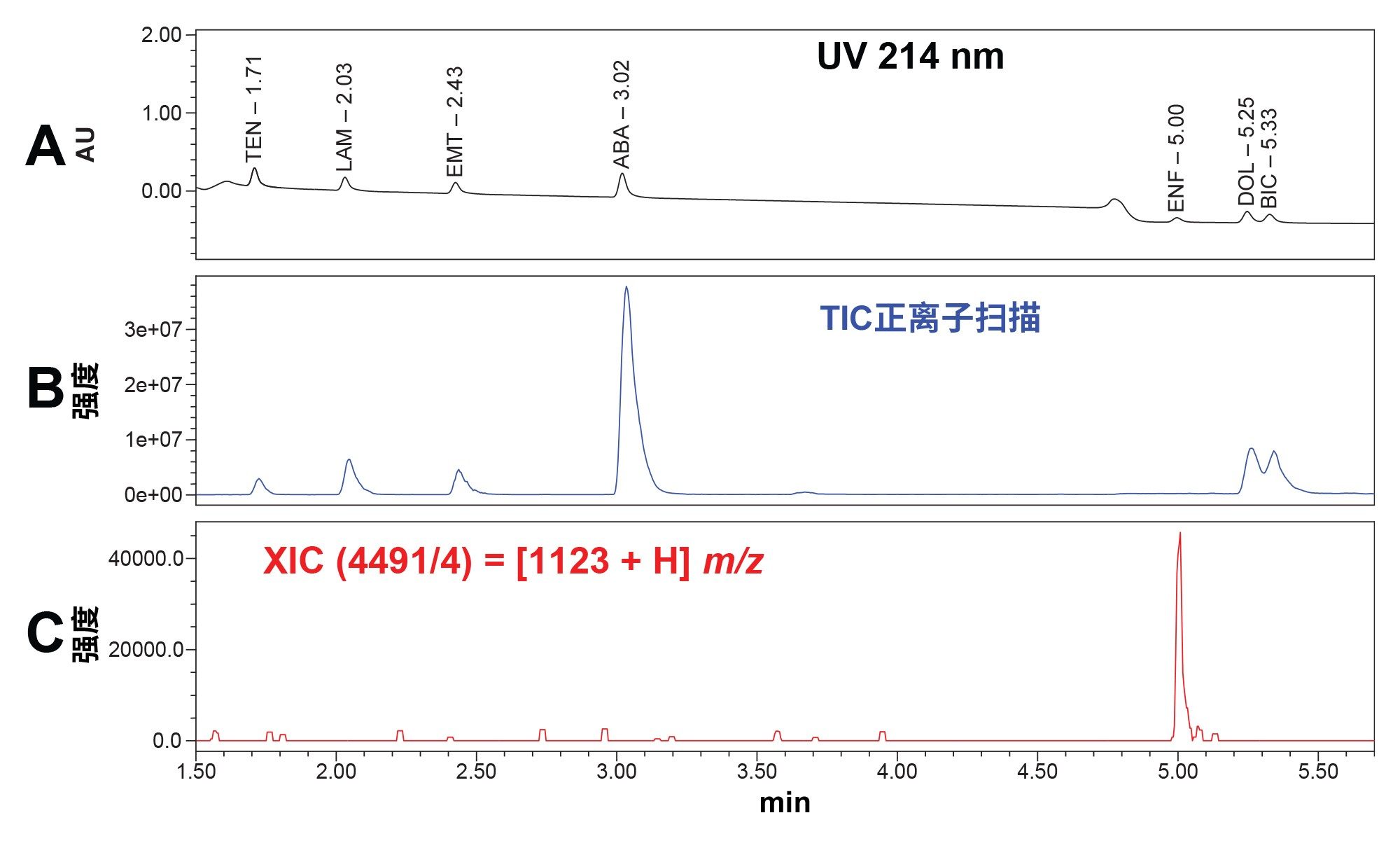
图2b.正离子扫描模式下浓度为10 μg/mL的HIV药物标准品的TIC色谱图。
图2c.浓度为10 μg/mL的恩夫韦肽的m/z处的XIC色谱图,展示了使用台式ACQUITY QDa质谱检测器检测肽的能力。
线性结果:
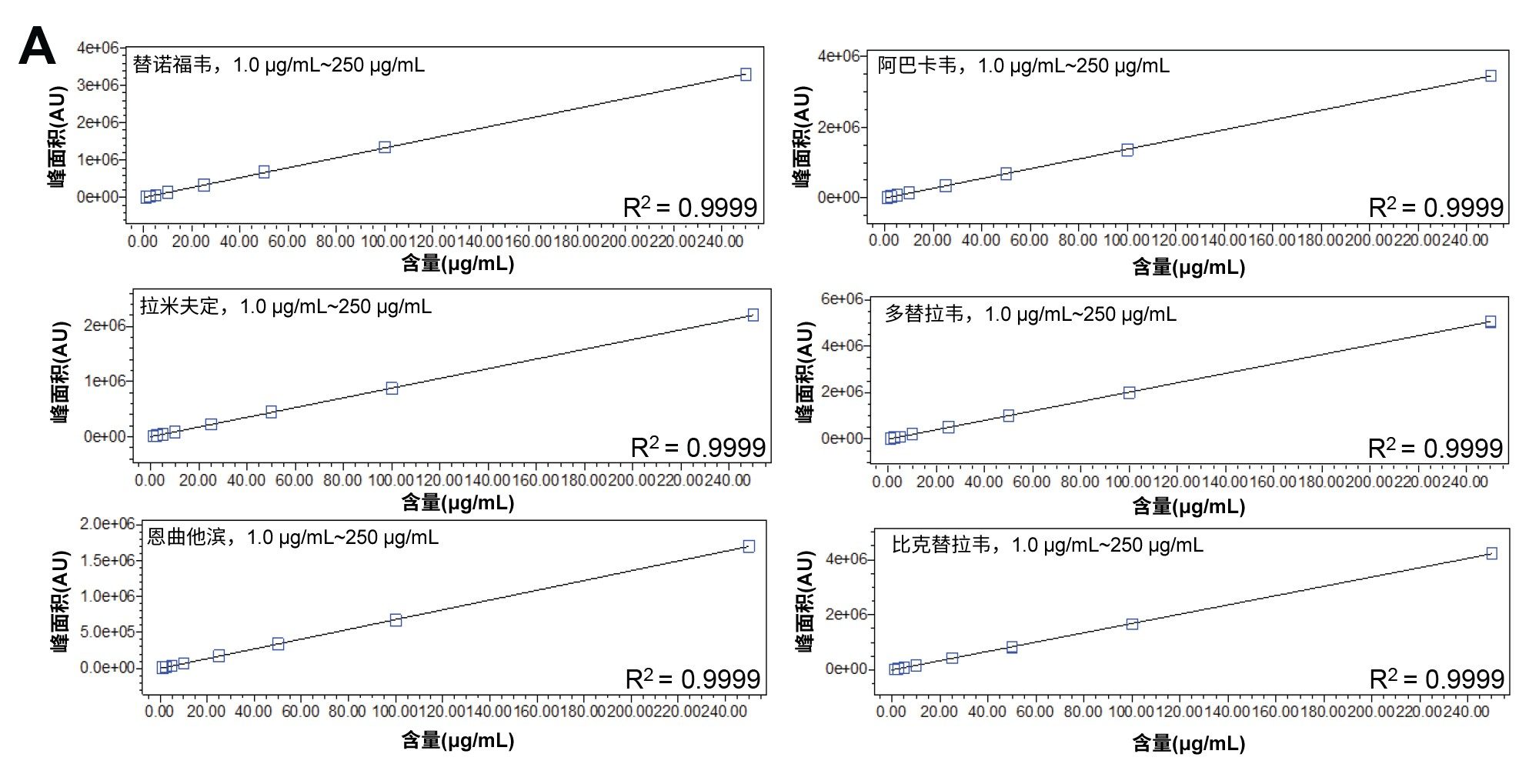
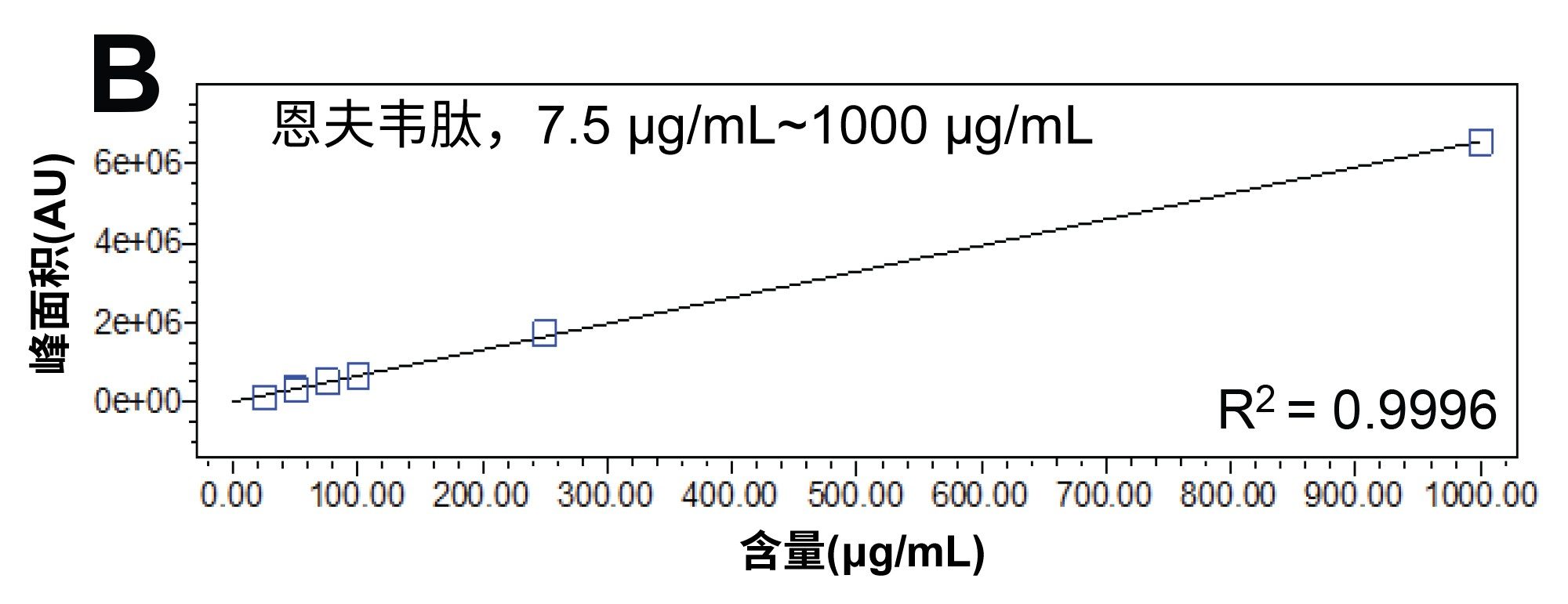
我们研究了HIV药物混标中每种分析物的线性。鉴于合成肽与小分子抗逆转录病毒药物的响应存在显著差异,因此单独考察了恩夫韦肽的线性。利用Empower 3中的校准功能进行线性拟合,计算每种分析物的线性结果。所有线性回归系数均≥0.999。该方法的定量能力显而易见,表明它可用于质量控制检测(图3a和3b)。
Premier与不锈钢系统的结果比较:
该方法分别应用于不锈钢系统和MaxPeak Premier系统,以彰显MaxPeak HPS技术在合成肽分析方面的改进。在每种类型的仪器中各进样10次恩夫韦肽适应性标准品。MaxPeak HPS提供了更具重现性的数据集,峰面积增加了23%,峰高增加了10%。下面比较了两种系统的结果(表6,图4a到4b)。
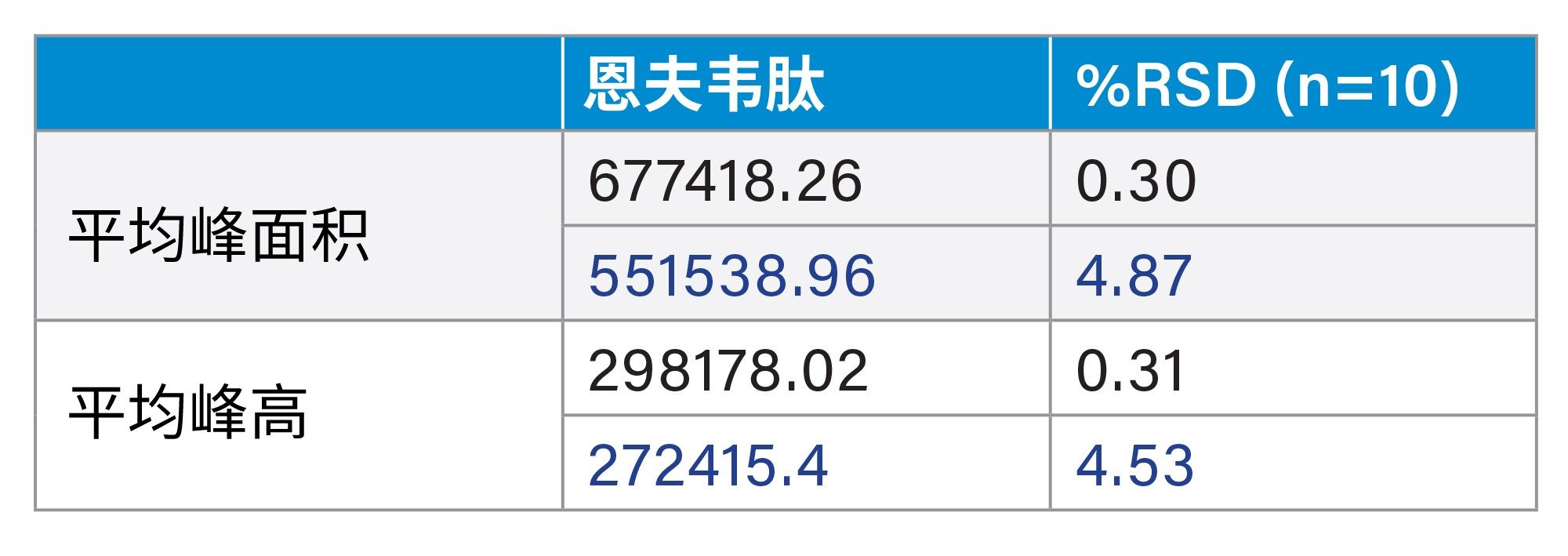
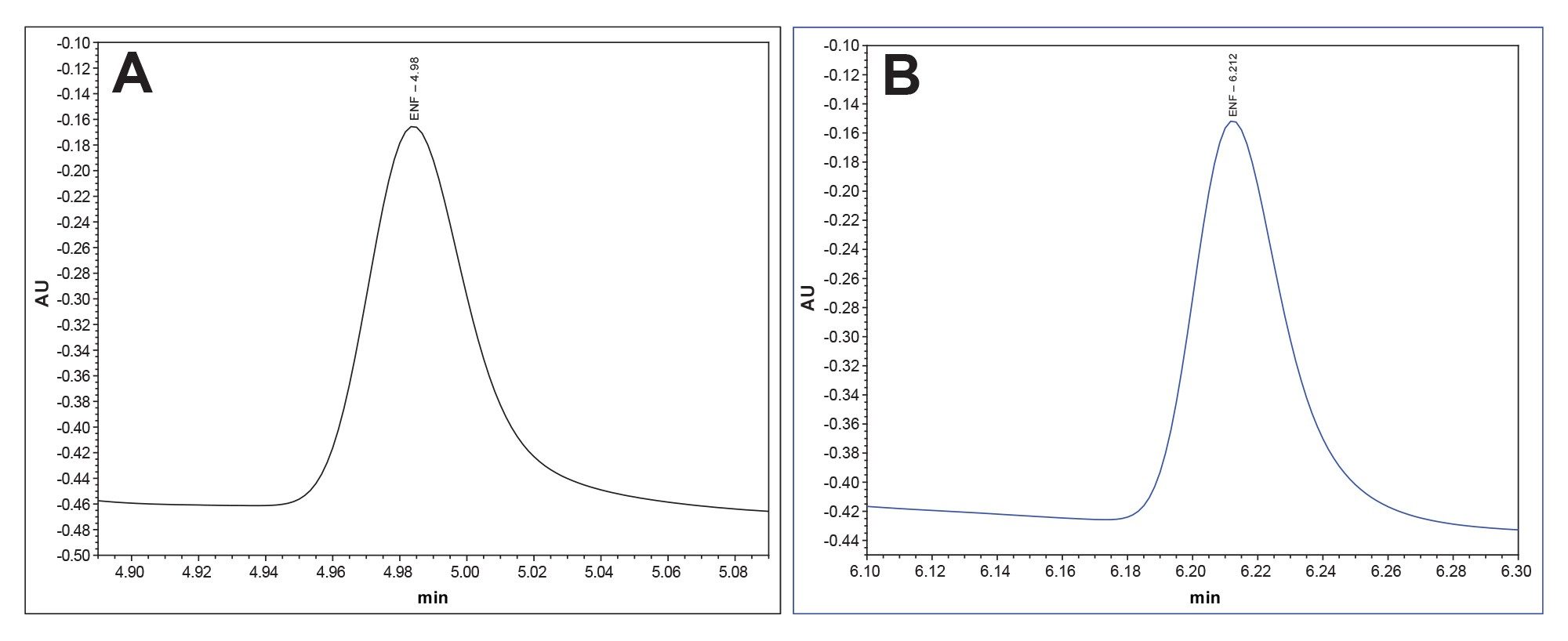
图4b.使用传统不锈钢系统分析恩夫韦肽适应性标准品获得的恩夫韦肽代表性色谱图(蓝色)。
定量限结果:
随着峰高和峰面积的增加,MaxPeak HPS系统的灵敏度也有所提高。为了衡量这一点,我们查看了每个系统的LOQ。根据人用药品注册技术要求国际协调会议(ICH)的规定,LOQ可以通过信噪比来测量15。 Premier MaxPeak HPS系统的LOQ标准品为3.5 μg/mL。在每套系统上将该标准品进样分析10次。Premier MaxPeak HPS系统的平均信噪比为14.2,高于建议的LOQ信噪比10。传统不锈钢系统的平均信噪比为2.4,低于建议的检测限(LOD)信噪比。MaxPeak HPS提供的信号峰面积和峰高增加有助于降低LOQ。(图5a和5b)。
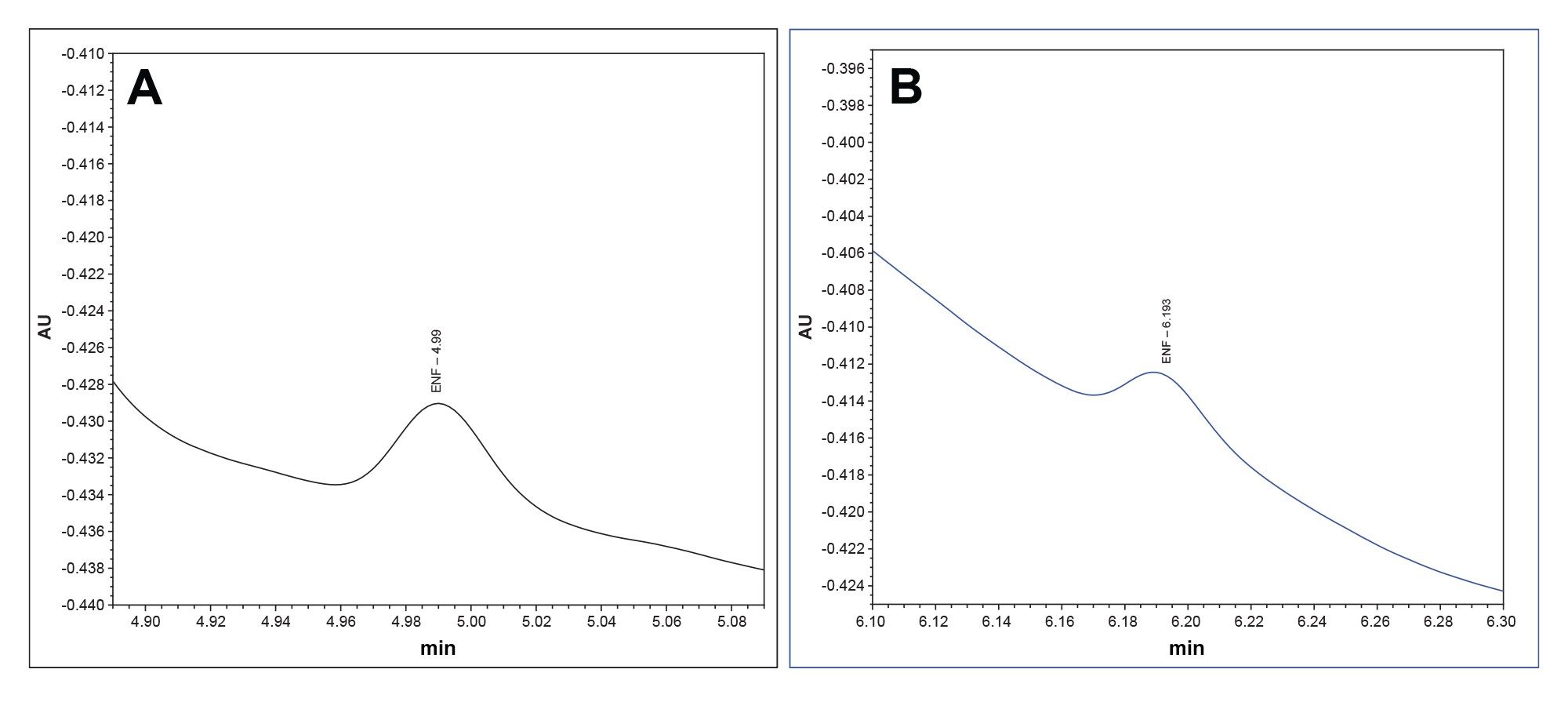
图5b.在传统不锈钢系统中进样恩夫韦肽(3.5 μg/mL)得到的代表性色谱图(蓝色)。10次进样的平均信噪比为2.4。
结论
在本应用纪要中,我们介绍了一种线性、可重现的方法,用于分析HAART和恩夫韦肽。该方法使用ACQUITY QDa质谱检测器,通过UV和台式质谱仪检测,在6分钟内即可分离和检测分析物。与传统的不锈钢系统相比,MaxPeak HPS解决方案改善了恩夫韦肽的色谱峰面积、峰高和整体灵敏度。
参考资料
- UNAIDS.Global HIV & AIDS Statistics — 2020 Fact Sheet.2021.参考网站:https://www.unaids.org/en/resources/fact-sheet
- Centers for Disease Control and Prevention.HIV Basics.2019.参考网站:https://www.cdc.gov/hiv/basics/index.html
- Centers for Disease Control and Prevention.AIDS and Opportunistic Infections.2019.参考网站:https://www.cdc.gov/hiv/basics/livingwithhiv/opportunisticinfections.html
- Pan American Health Organization.Antiretroviral Therapy - PAHO/WHO | 2023.参考网站:https://www.paho.org/en/topics/antiretroviral-therapy#:~:text=Antiretroviral%20therapy%20(ART)%20is%20treatment
- National Institute of Health.Appendix B: Drug Characteristics Tables | NIH.2023 [cited 2023 Aug 11].参考网站: https://clinicalinfo.hiv.gov/en/guidelines/hiv-clinical-guidelines-adult-and-adolescent-arv/drug-characteristics-tables?view=full#table7
- National Institutes of Health.Enfuvirtide - Patient | NIH.2023.参考网站:https://clinicalinfo.hiv.gov/en/drugs/enfuvirtide/patient
- PubChem.Enfuvirtide.National Center for Biotechnology Information.2023.参考网站:https://pubchem.ncbi.nlm.nih.gov/compound/Enfuvirtide
- Charbe N, Baldelli S, Cozzi V, Castoldi S, Cattaneo D, Clementi E. Development of an HPLC–UV Assay Method for the Simultaneous Quantification of 9 Antiretroviral Agents in the Plasma of HIV-Infected Patients.Journal of Pharmaceutical Analysis.December 2016.6(6):396–403.
- D’Avolio A, Siccardi M, Sciandra M, Lorena B, Bonora S, Trentini L, et al.HPLC–MS Method for the Simultaneous Quantification of the New HIV Protease Inhibitor Darunavir, and 11 other Antiretroviral Agents in Plasma of HIV-Infected Patients.Journal of Chromatography B.November 2007.859(2):234–40.
- Birdsall R, Kellet J, Ippoliti S, Qing Yu Y. 使用Waters ACQUITY Premier解决方案提高“酸性”肽的回收率和色谱性能.沃特世应用纪要.720007173ZH.2021.
- Buck MA, Olah TA, Weitzmann CJ, Cooperman BS.Protein Estimation by the Product of Integrated Peak Area and Flow Rate.Analytical Biochemistry.Nov 1989.[cited 2023 Aug 11].182(2):295-9.参考网站: https://www.sciencedirect.com/science/article/abs/pii/0003269789905976?via%3Dihub
- U.S. Food and Drug Administration.Reviewer Guidance, Validation of Chromatographic Methods.FDA U.S. Food and Drug Administration.2018.参考网站:https://www.fda.gov/regulatory-information/search-fda-guidance-documents/reviewer-guidance-validation-chromatographic-methods
- Instrument Specifications ACQUITY QDa Detector.Waters Corporation; 2016 [cited 2023 Aug 11].参考网站: https://www.waters.com/webassets/cms/library/docs/720004799en.pdf
- Chang D, Kolis SJ, Linderholm K, Julian TF, R. Nachi, A.M. Dzerk, et al.Bioanalytical Method Development and Validation for a Large Peptide HIV Fusion Inhibitor (Enfuvirtide, T-20) and Its Metabolite in Human Plasma Using LC–MS/MS.Journal of Pharmaceutical and Biomedical Analysis.2005 Jul 1;38(3):487-96.
- International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use Ich Harmonised Tripartite Guideline Validation of Analytical Procedures: Text and Methodology Q2(R1). ICH.November 2005.参考网站: https://database.ich.org/sites/default/files/Q2%28R1%29%20Guideline.pdf
720008072ZH, 2023年10月