基于“分析方法质量源于设计”的理念开发使用Arc Premier™系统分析感冒药和咳嗽药的方法
摘要
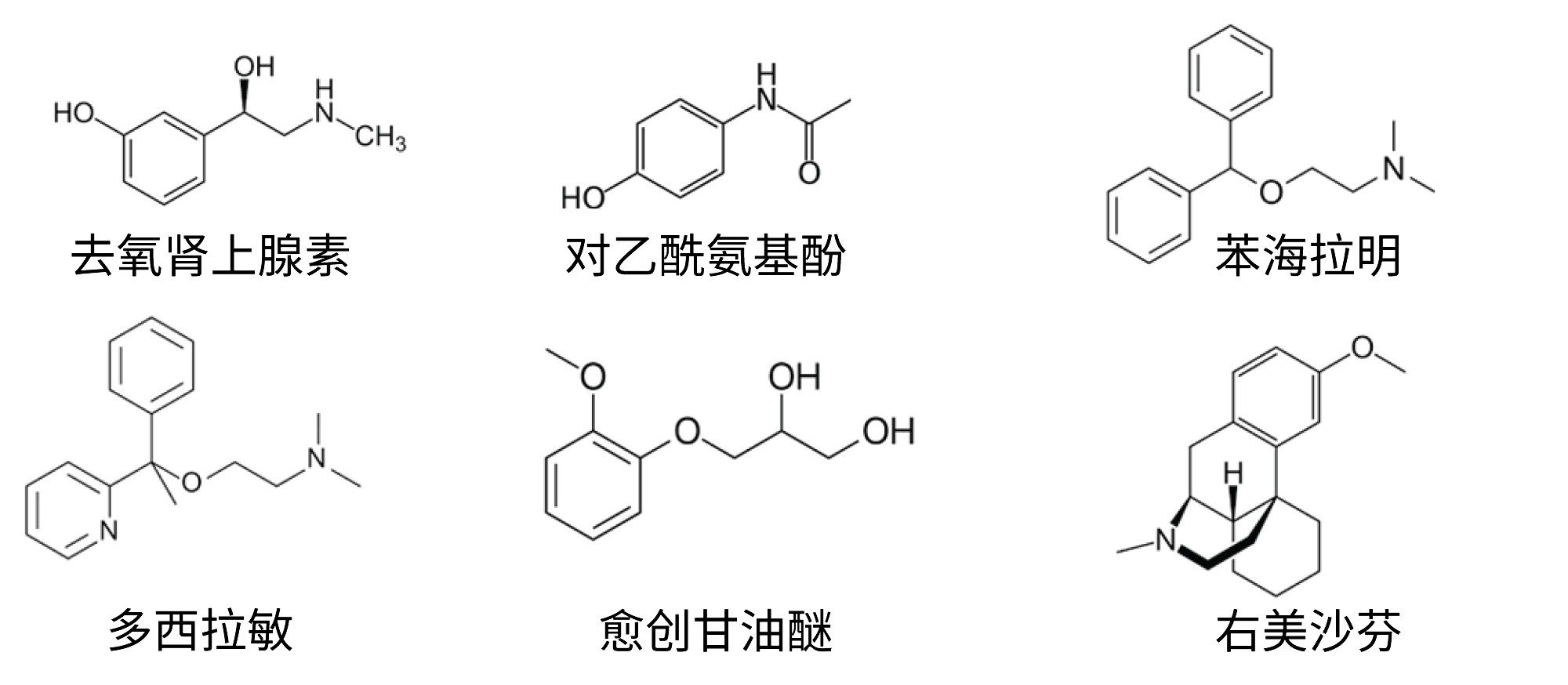
使用Arc™ Premier系统以及质谱兼容的流动相和添加剂,分离活性药物化合物去氧肾上腺素、对乙酰氨基酚、琥珀酸多西拉敏、愈创甘油醚、右美沙芬和苯海拉明,运行时间仅11 min。方法开发符合ICH Q14和USP <1220>指导原则中所述的“分析方法质量源于设计(AQbD)”理念,并使用Fusion QbD®软件(S-Matrix Corporation)进行。向四种止咳糖浆制剂中添加不同浓度的强吸收性山梨酸钾辅料,成功测试了最终方法的重现性。
优势
- 一种分离去氧肾上腺素、对乙酰氨基酚、琥珀酸多西拉敏、愈创甘油醚、右美沙芬和苯海拉明的方法,我们使用四种止咳糖浆制剂(样品中添加了强吸收性山梨酸钾辅料)测试了该方法。所有活性药物成分(API)的峰均表现出光谱同质性,且性能特征保持不变
- 一种使用Arc Premier系统和2.7 μm CORTECS™色谱柱的快速、可靠且可重现的方法
- 流动相与质谱兼容,允许使用质谱检测器进行峰鉴定和定量
- 在Fusion QbD软件的协助下,将ICH Q14“分析程序开发”和USP <1220>“分析程序生命周期”指导原则的各个方面纳入方法开发工作流程
简介
市面上用于缓解普通感冒和流感症状的止咳糖浆制剂各式各样。这些药物中添加的API包括减充血剂、止咳药、祛痰药、止痛药、退烧药和/或抗组胺药1。 这些API通过各种递送方式给药,例如丸剂、胶囊和糖浆。每种递送方式都会使用辅料来改善产品质量。在糖浆制剂中,辅料用于改变糖浆的甜味、稠度、风味、颜色、抗菌性和缓冲性。由于这些制剂均属于各自药企专有,因此市场上出现了种类繁多、浓度各异的API和辅料。允许用于不同药物制剂的食品添加剂约有300种2。 一项研究发现,在60种止咳糖浆制剂中存在上百种不同的辅料3。 这些辅料会引起棘手的基质效应和共流出问题,给制剂分析带来挑战1。
HPLC是分析止咳糖浆的常用方法,因为它能够以高灵敏度和高选择性分离和定量API和辅料4。 目前,业界使用单独的色谱方法来分析药物制剂中的各种API。这种方法虽然有效,但可能非常耗时,并且会产生大量有害的有机溶剂废液。为提高此类分析的效率,使用一种色谱方法来分析各种药物制剂中的多种API不失为一种解决方案。
AQbD是一种系统性的分析方法开发理念,部分通过识别并控制整个方法生命周期中的变数来确保方法质量。AQbD原则在制药行业的重要性与日俱增,USP和ICH等监管机构都在强调对质量保证和控制的要求。AQbD需要用到统计工具、实验设计(DOE)、风险评估和知识管理来提高方法的稳定性、可靠性和一致性。采用AQbD原则,分析人员可以减少方法开发的时间和成本,同时提高分析结果的整体质量。
软件工具可协助用户设计和执行实验、分析数据和优化方法,从而在分析方法开发中实施AQbD原则。该软件有助于识别给定方法的关键方法参数(CMP)和关键方法属性(CMA),还有助于确定CMP与CMA之间的关系,使用户能够识别影响方法质量的重要因素。
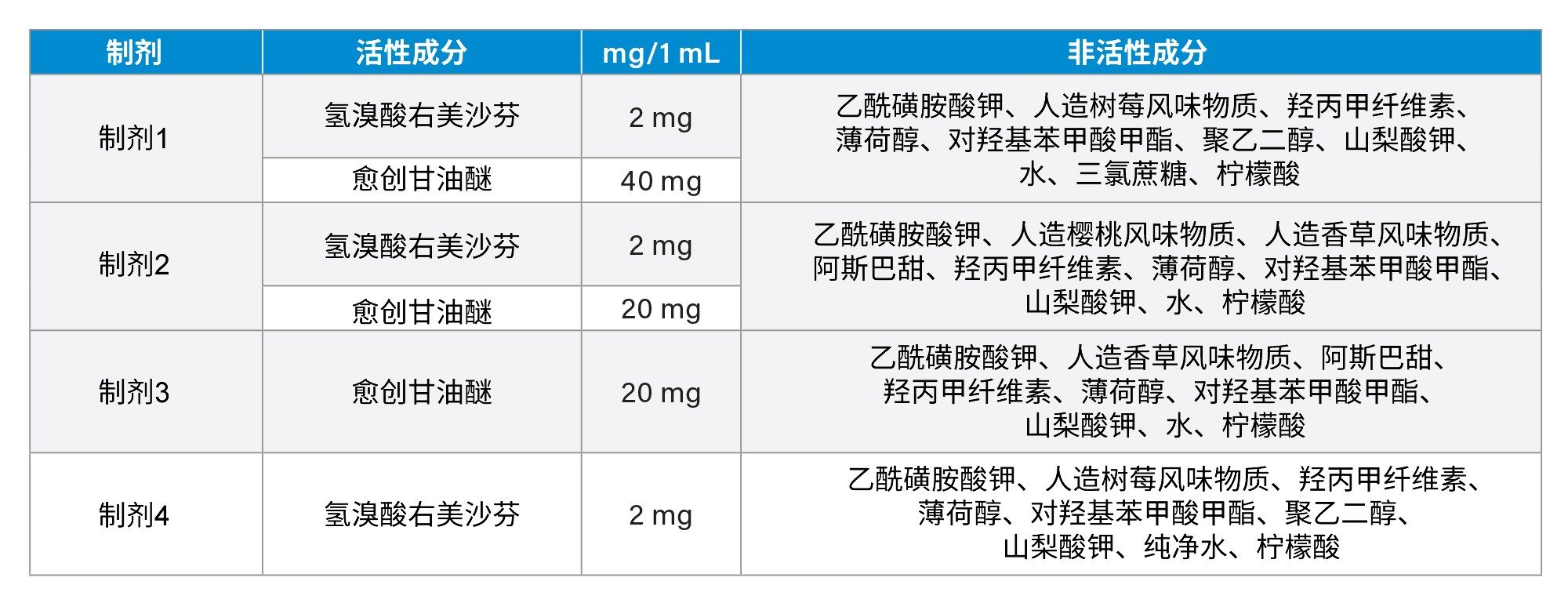
在本文所述的研究中,我们开发了一种分离止咳糖浆制剂中六种API的UHPLC分析方法。我们使用四种制剂测试了该方法,结果表明当添加100%山梨酸钾时,每种制剂中的API都能保持一致的分离度和峰纯度。
实验
样品前处理
将去氧肾上腺素、对乙酰氨基酚、琥珀酸多西拉敏、愈创甘油醚、右美沙芬和苯海拉明溶于去离子水中,制得浓度为1 μg/mL的标准溶液。这六种API的化学结构如图1所示。所有制剂均购自在线药店,含量见表1。将这些制剂用去离子水稀释1000倍,制备待分析样品。还制备了加标样品:用去离子水将这些制剂稀释1000倍,然后加入三种不同浓度的山梨酸钾(20%、50%和100%)。100%是制剂中山梨酸钾含量的两倍。
筛选的液相色谱条件:
|
色谱柱: |
1. CORTECS Premier C18 2.7 μm 2.1 X 100mm 2. CORTECS Premier C18+ 2.7 μm 2.1 X 100mm 3. CORTECS Premier T3 2.7 μm 2.1 X 100mm 4. CORTECS Premier苯基柱, 2.7 μm 2.1 X 100mm |
|
柱温: |
30-45 °C |
|
流速: |
0.6 mL/min |
|
流动相A: |
0.1%甲酸的去离子水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度: |
乙腈在3–15分钟内从3%增加到70% |
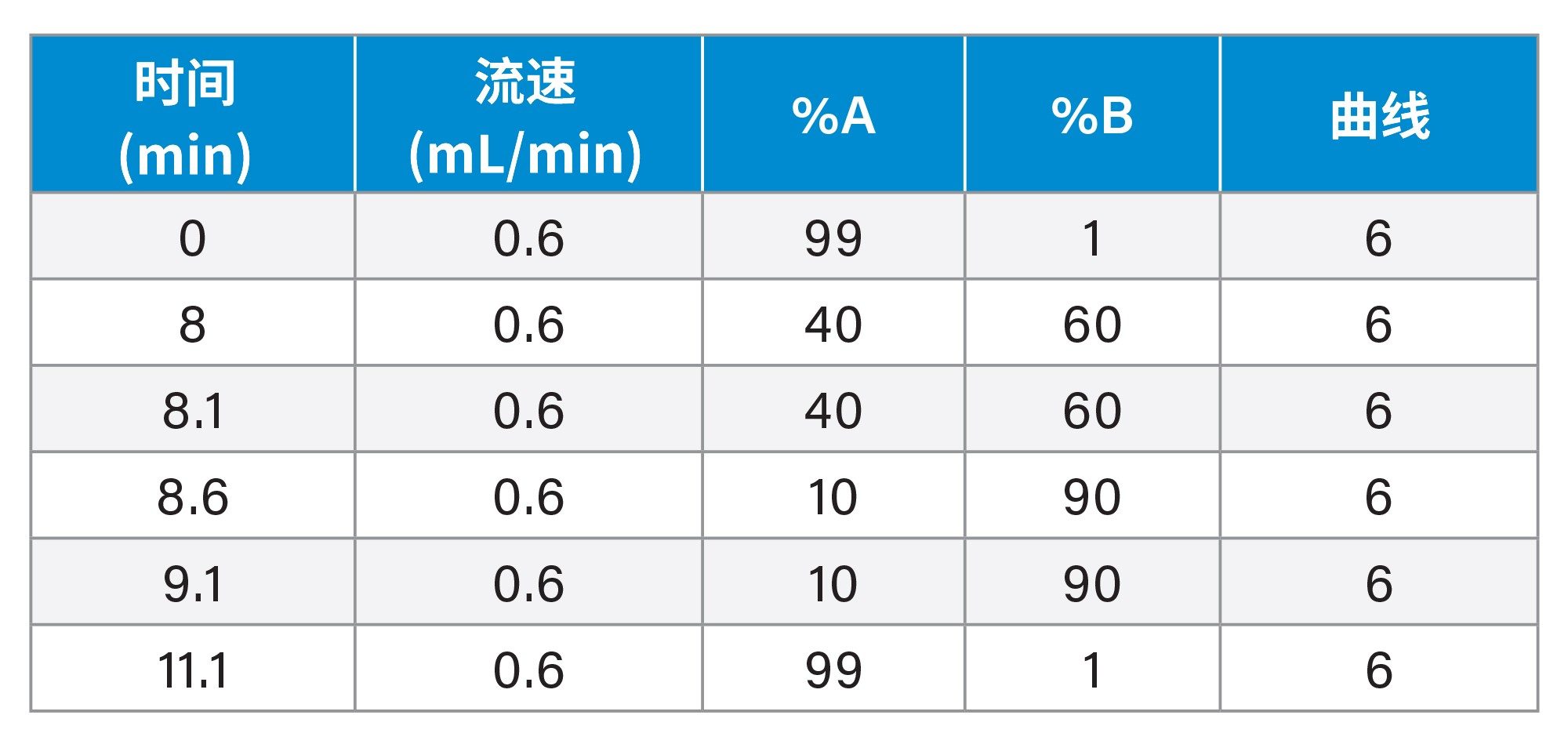
最终液相色谱条件:
|
液相色谱系统: |
Arc Premier系统 四元溶剂管理器 样品管理器FTN-R 带辅助装置的色谱柱管理器 |
|
检测: |
PDA 2998 ACQUITY QDa™质谱检测器 |
|
样品瓶: |
2 mLTrueView |
|
色谱柱: |
CORTECS Premier T3 2.7 μm 2.1 X 100mm |
|
柱温: |
45 °C |
|
样品温度: |
20 °C |
|
进样体积: |
10 μL |
|
流速: |
0.6 mL/min |
|
流动相A: |
0.1%甲酸的去离子水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
梯度表:
数据管理
|
色谱软件: |
Empower™软件3.6.1 |
|
信息学软件: |
Fusion QbD 9.9.1.b Build 334 |
结果与讨论
本研究部署的方法开发工作流程包括多个步骤,均符合监管机构在USP <1220>和ICH Q14文件中概述的AQbD原则5,6。这些步骤包括:确定分析目标概况(ATP)、风险评估、创建实验设计、确定方法操作设计区域、优化和验证。使用该工作流程可以创建高质量方法。
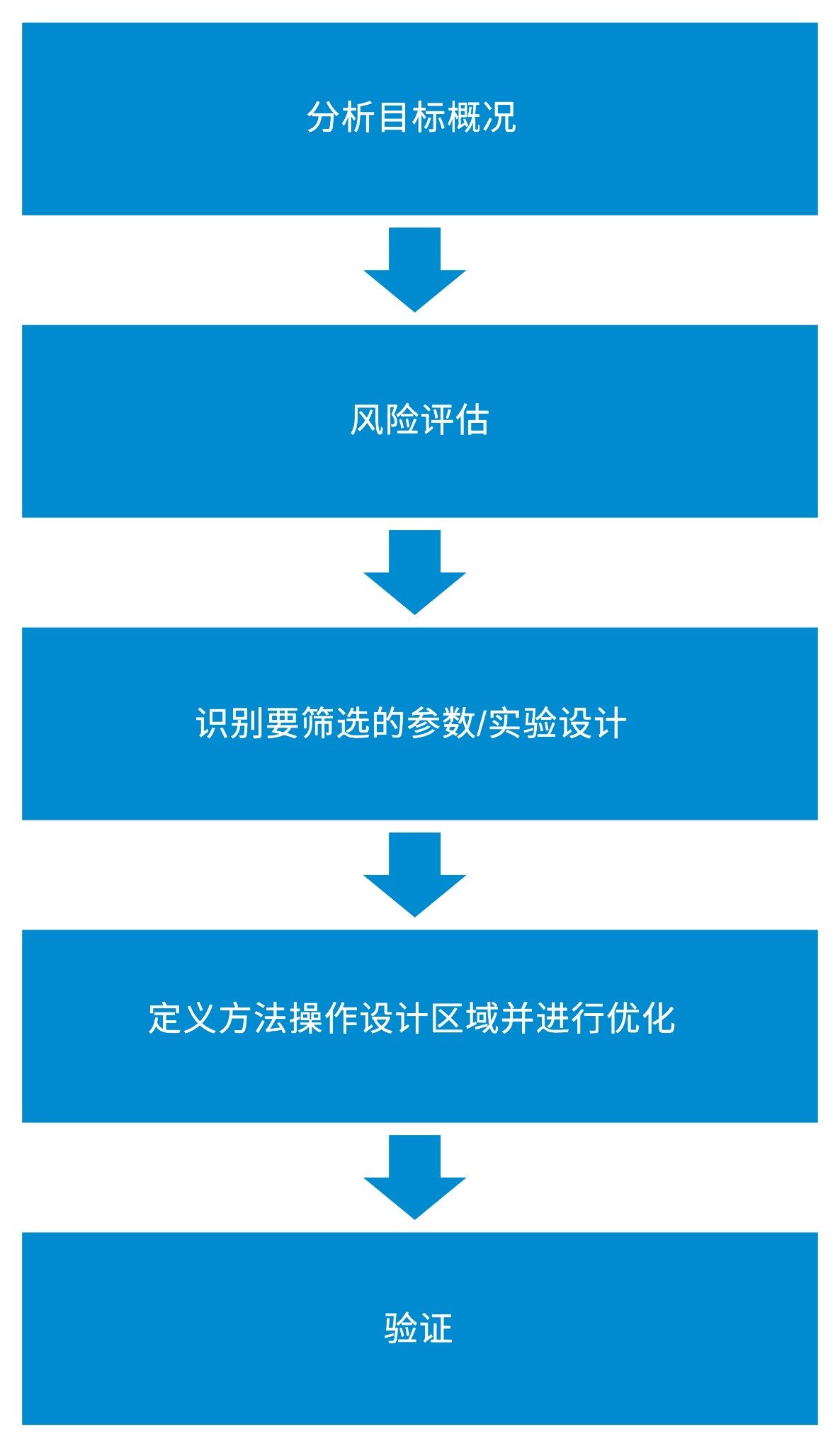
分析目标概况
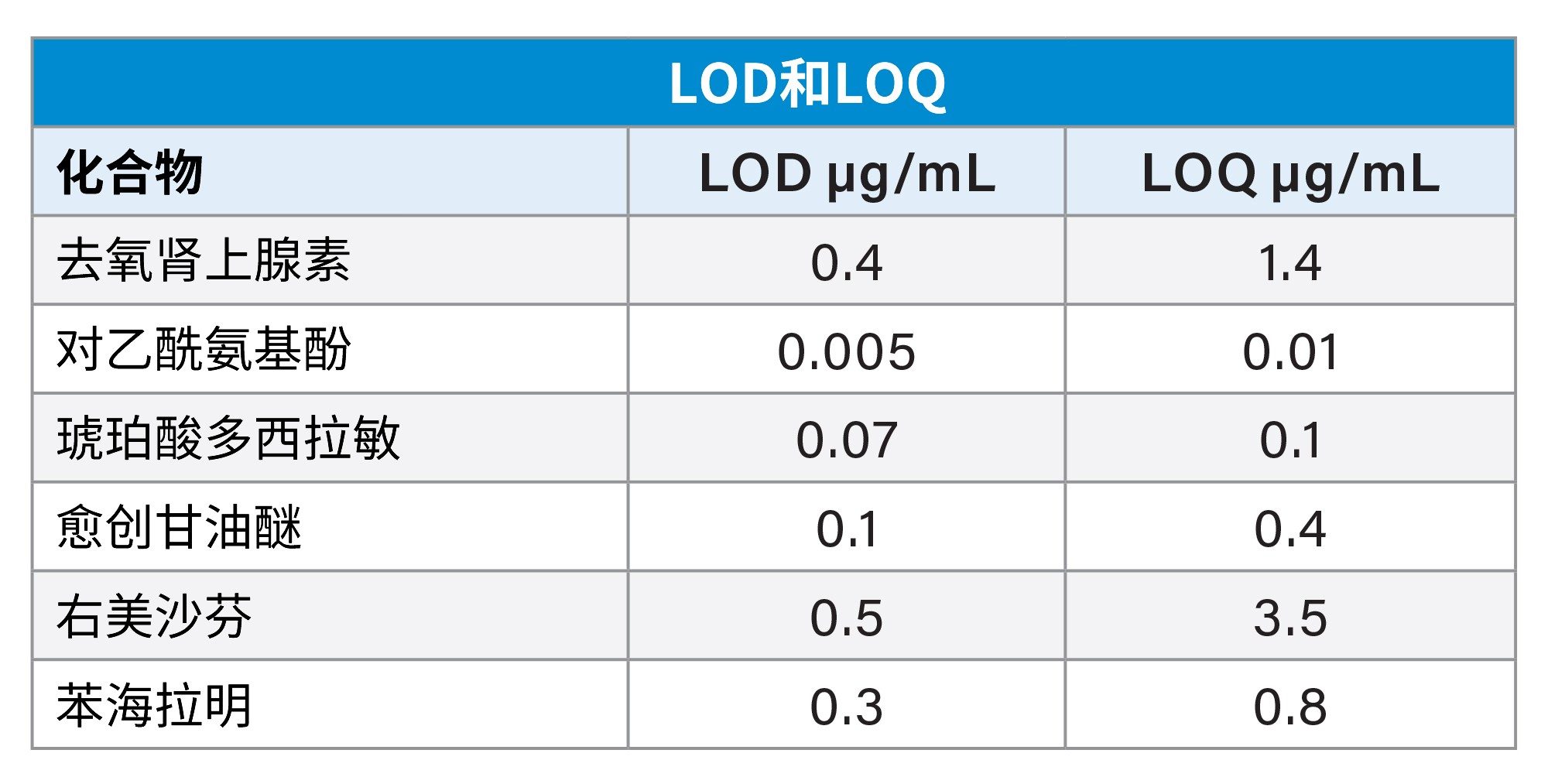
在开发分析方法时,分析目标概况(ATP)是AQbD理念的关键要素。它包含一组特定的衡量特性,必须确保分析方法满足这些特性,才能使其适用于预期用途。ATP由关键分析物属性和性能特征组成,包括但不限于偏差、精密度、特异性、检测限、定量限、线性、范围、耐用性和稳定性。ATP通过为分析方法的开发和优化提供指导来确保方法满足预定义标准,从而得到符合预期目标的方法。
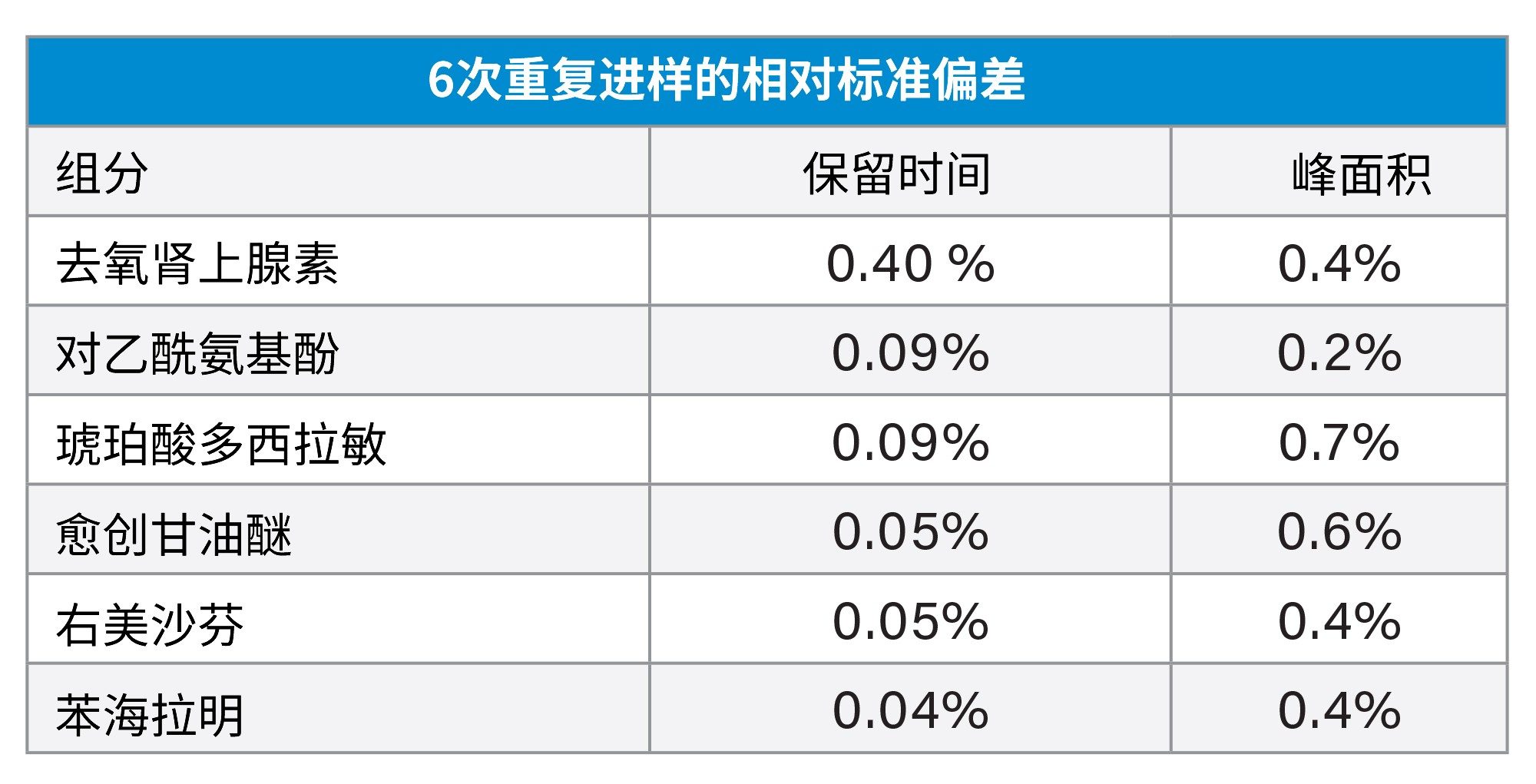
在本研究中,ATP旨在开发一种精密的方法,能够分离不同感冒/止咳糖浆制剂中存在的API与辅料,并且获得可接受的检测限和定量限。我们需要所有分析物峰保留时间和峰面积的相对标准偏差小于1%,才能证明准确度和精密度。该方法需要在待测制剂中添加了大量辅料山梨酸钾的情况下依然能保持优异性能。
本研究首先选择一种合适的技术,根据已有知识确定为Arc Premier系统,并配备四元溶剂管理器(QSM)、色谱柱管理器(CM)和溶剂选择阀,以便能够自动探索各种条件。研究还采用了QDa质谱检测器来协助方法开发和峰鉴定。在本研究中,保持方法与质谱兼容非常重要,因为某些分析物的UV吸光度较低,可以通过质谱检测器完成定量。研究确定,在QA/QC阶段使用该方法时,由于增加压力和缩短运行时间可能有益,CORTECS色谱柱的实心核技术将发挥有利作用。
风险评估
在研究的这一阶段,我们全面评估了可能对方法生成的数据的质量及其实现目标的能力有影响的高风险参数。此评估基于可靠的色谱原理、现有知识和专业知识。
鉴于色谱柱固定相对化合物分离的重大影响,本研究将其视为高风险因素。因此,本研究选择了四种不同的固定相填料进行筛选,以确保广泛的选择性并尽可能提高成功分离所有分析物的可能性。此外还假设pH对分析方法的性能有重大影响。因此,我们在较宽的pH范围内开展了初步实验,结果表明对于大多数分析物而言,较低的pH值更为理想。梯度时间和柱温均被视为高风险因素,因为这些因素可能导致制剂发生共流出。因此我们认为需要在方法开发过程的后续步骤中深入研究这两个因素。假设样品前处理对标准品和制剂的风险较低,因为所有样品都是水溶性的,更容易萃取目标分析物且降低了强溶剂效应的风险。研究发现,由于制剂耐储存,因此稳定性是一个相对较低的风险因素。所有方法都需要仔细考虑检测问题。在方法开发过程中,质谱主要用于峰鉴定,但也可用于定量某些分析物。这些制剂中的化学成分的化学性质差异很大,并没有适合所有分析物的UV波长,因此使用标准的254 nm。检测方法和参数会影响LOD和LOQ,但不影响保留时间。我们认为这些因素对方法仅有低风险,因为ATP侧重于分离,而不是低检测限。为了说明所有方法参数及其各自的影响,我们在图3中绘制了鱼骨图。
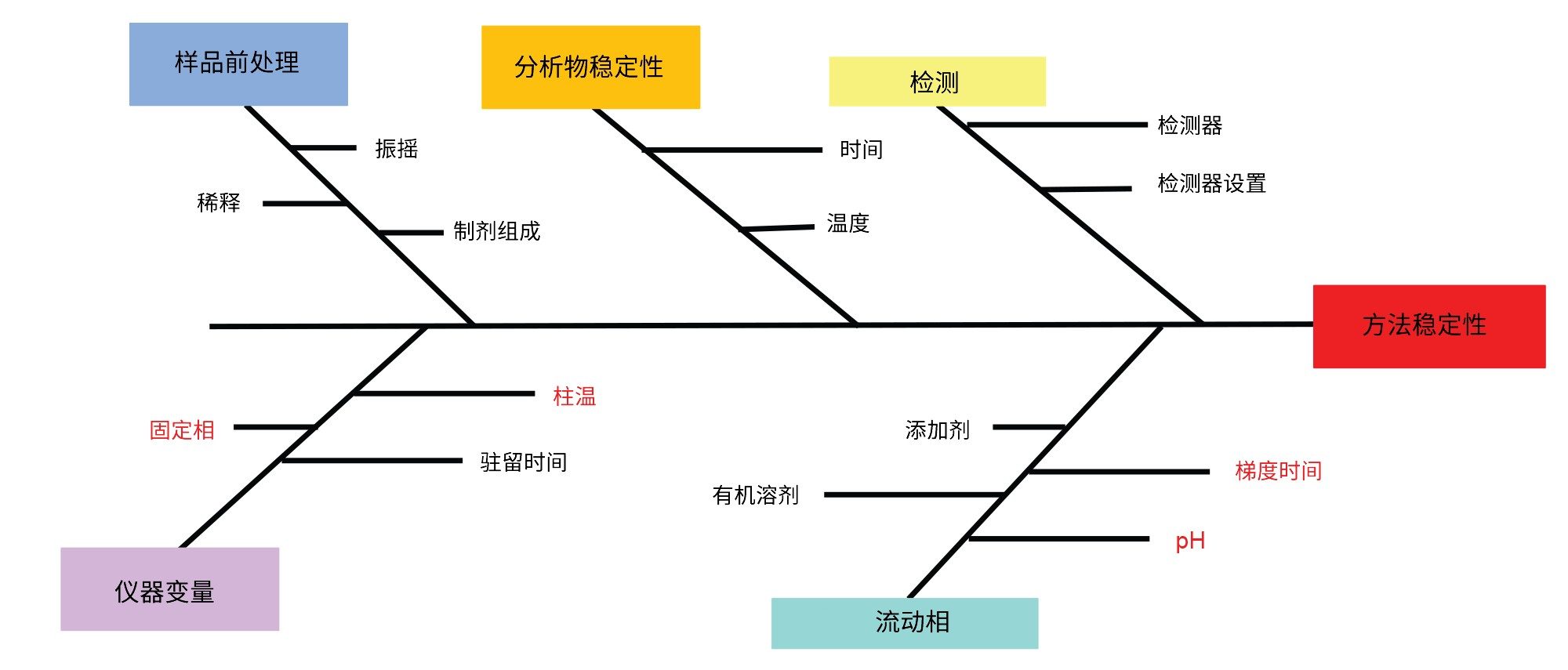
实验设计
在研究的这一阶段,我们根据风险评估过程中识别的关键方法属性和风险因素制定了DOE。这样做的目的是全面探讨色谱柱填料、梯度时间和温度对开发过程的影响。在Fusion QbD中选择实验的所有变量和常量后,该软件会使用统计抽样方法创建实验设计方案,包括32次分析运行。该软件会在Empower软件项目中自动创建所有必需的仪器方法和平衡/活化步骤。

实验设计
下一步是在Empower CDS中处理数据并导入Fusion QbD软件,以找到满足性能目标的总体最佳答案(BOA)。此筛选阶段设定的性能目标包括:分离度≥4的最大峰数以及USP拖尾因子≤1.5的最大峰数。这些目标是在目视检查筛选实验的色谱图后设定的。数据处理模拟的模型充分性为0.999,表明预计达到设定性能标准的最佳条件组合是CORTECS Premier T3色谱柱,柱温45 °C,梯度时间9 min。图4显示了MODR,其中白色区域代表满足设定性能特征的方法。
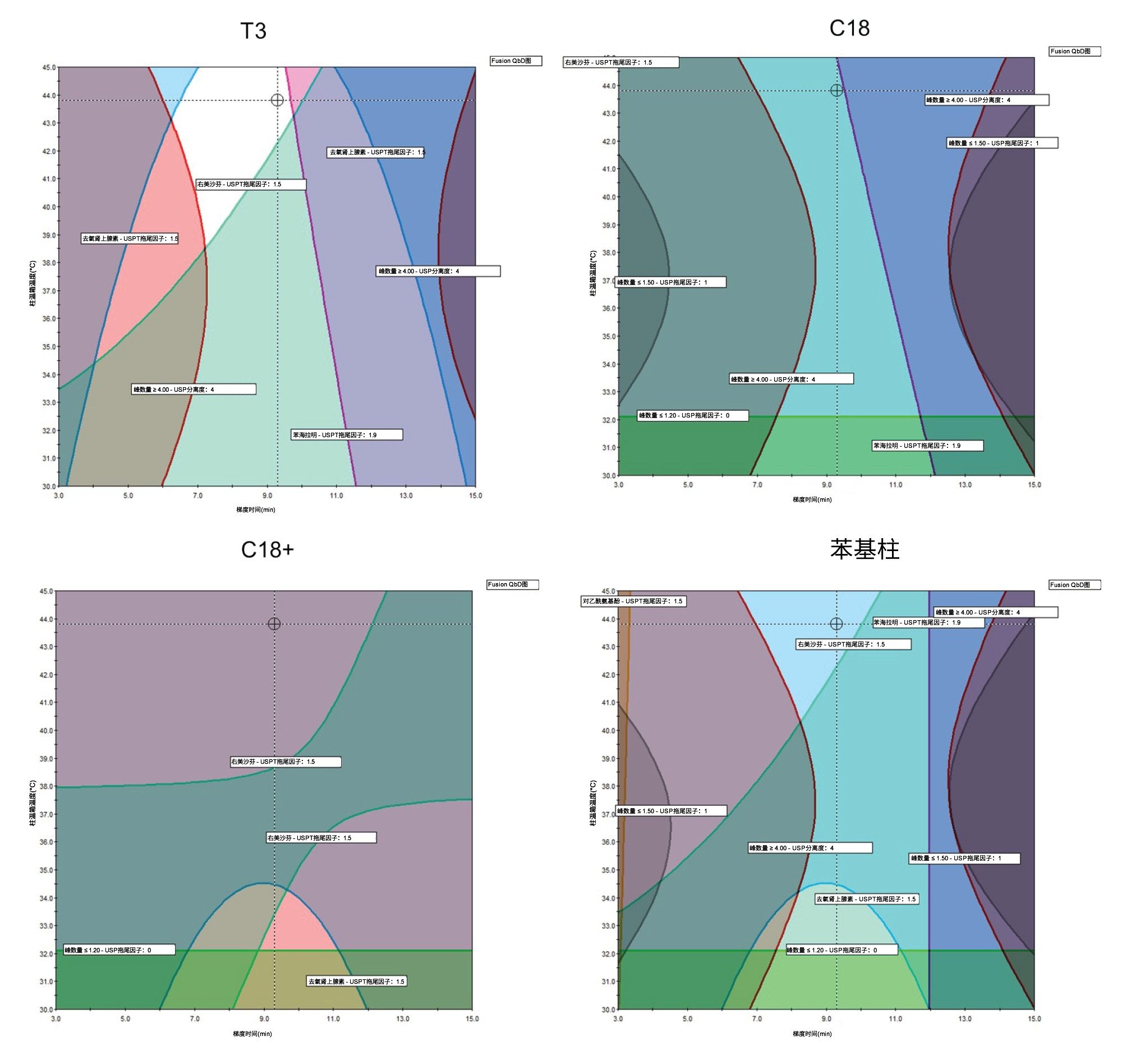
利用之前在风险评估阶段获得的知识和信息,进一步优化总体最佳答案,提高方法性能。BOA的优化不需要使用Fusion QbD软件。通过改变三项参数来改善方法的色谱特性,从而更好地分离制剂。在梯度的最后一分钟内无峰洗脱。为减少溶剂浪费并缩短运行时间,我们将方法的乙腈百分比上限降至60%,梯度时间缩短至8分钟,从而大致保持梯度斜率不变。第一个洗脱峰去氧肾上腺素的洗脱时间过于接近死体积时间,因此将梯度起点降至1%乙腈。
验证
6种API的最终分离结果见图5。除琥珀酸多西拉敏存在明显拖尾以外,其余所有分析物均满足方法性能目标。这种拖尾虽然不理想,但并未使方法重现性降低至可接受水平以下。重现性结果见表3;保留时间和峰面积的相对标准偏差表明该方法具有良好的重现性。这些结果实现了ATP中设定的目标。
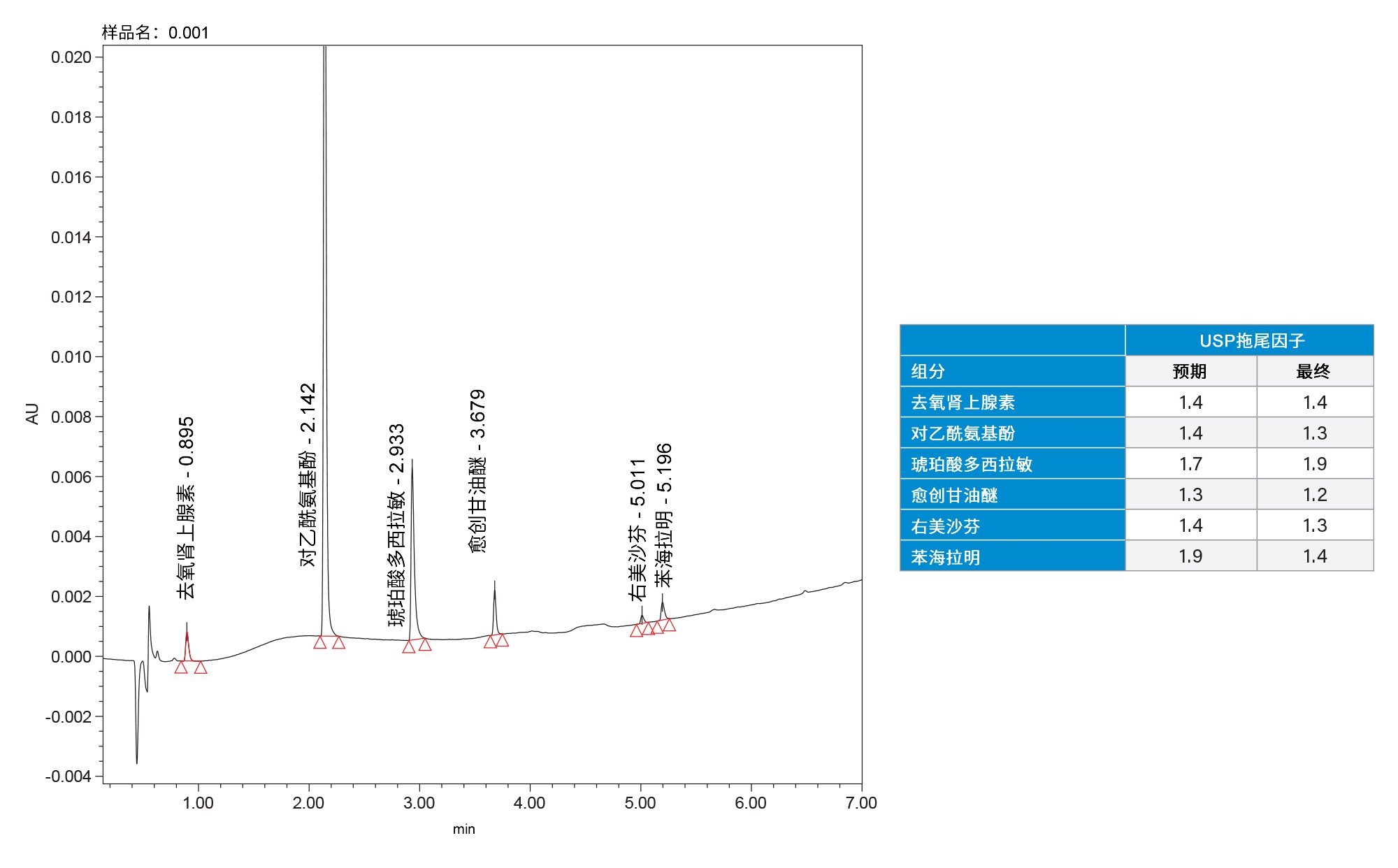
在方法验证和评估过程中,我们根据USP <621>指导原则评估了6种API的检测限(LOD)和定量限(LOQ)7。 使用空白样品和最新的USP指导原则计算噪音。计算采用的波长为254 nm,使用不同的波长或不同的检测器计算的LOD和LOQ可能会更低,因为没有一种检测方法能对所有API都达到理想状态。LOD和LOQ浓度均在可接受范围内。
方法应用:药物制剂、辅料添加和峰纯度
本研究阶段的目的是通过分析止咳糖浆药物制剂来评估所开发方法的性能。此外,我们还试图通过测定该方法准确检测样品中不同浓度某一辅料的能力来评估该方法的稳定性。由于山梨酸钾在此类制剂中较为常用,因此被定为目标辅料8。 这种抗菌和抗真菌辅料长期使用有可能产生毒性和致癌作用,因此需要密切监测9。 此外,它还具有强烈的UV吸收特性,是开发HPLC-UV方法的理想选择。
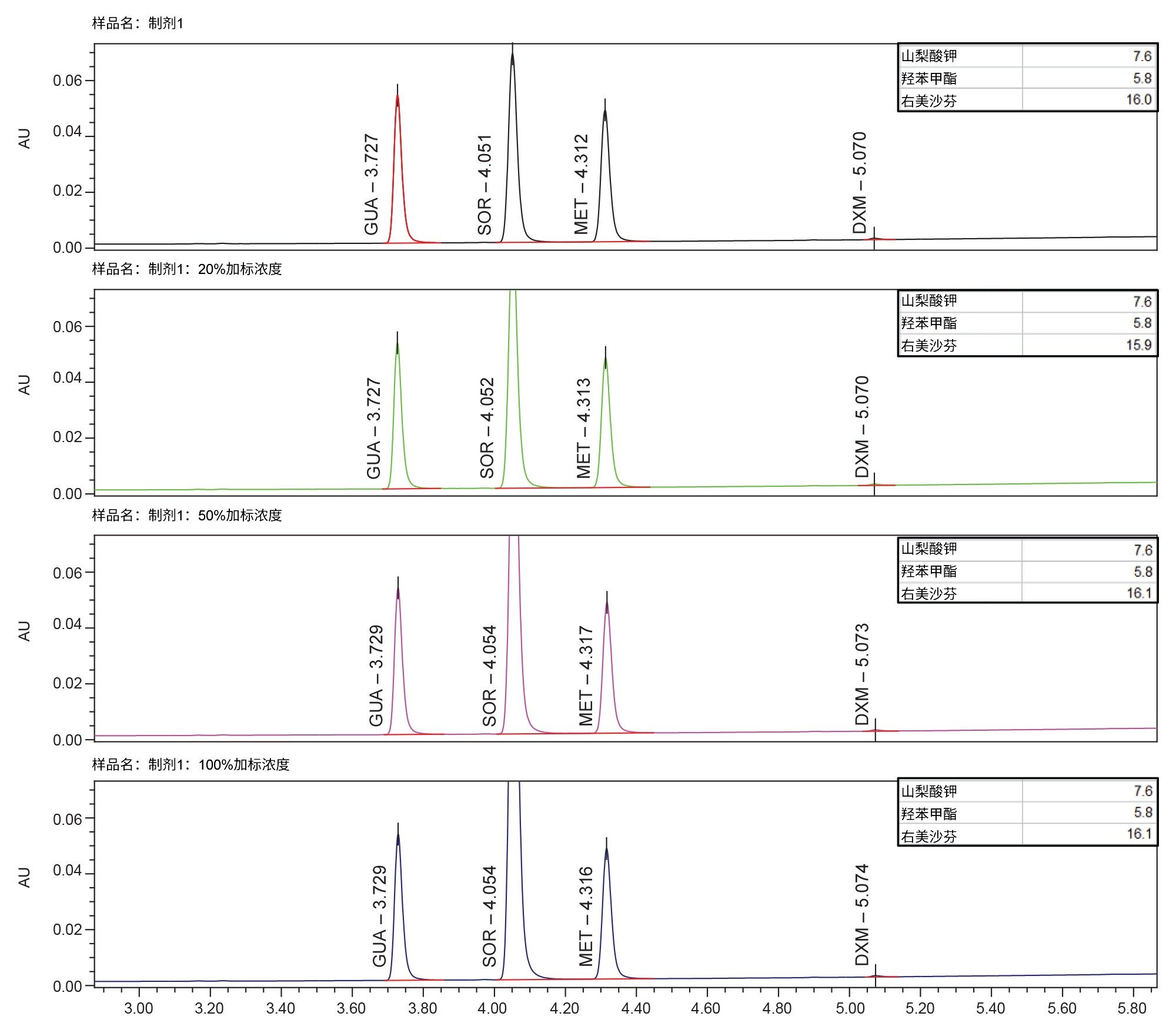
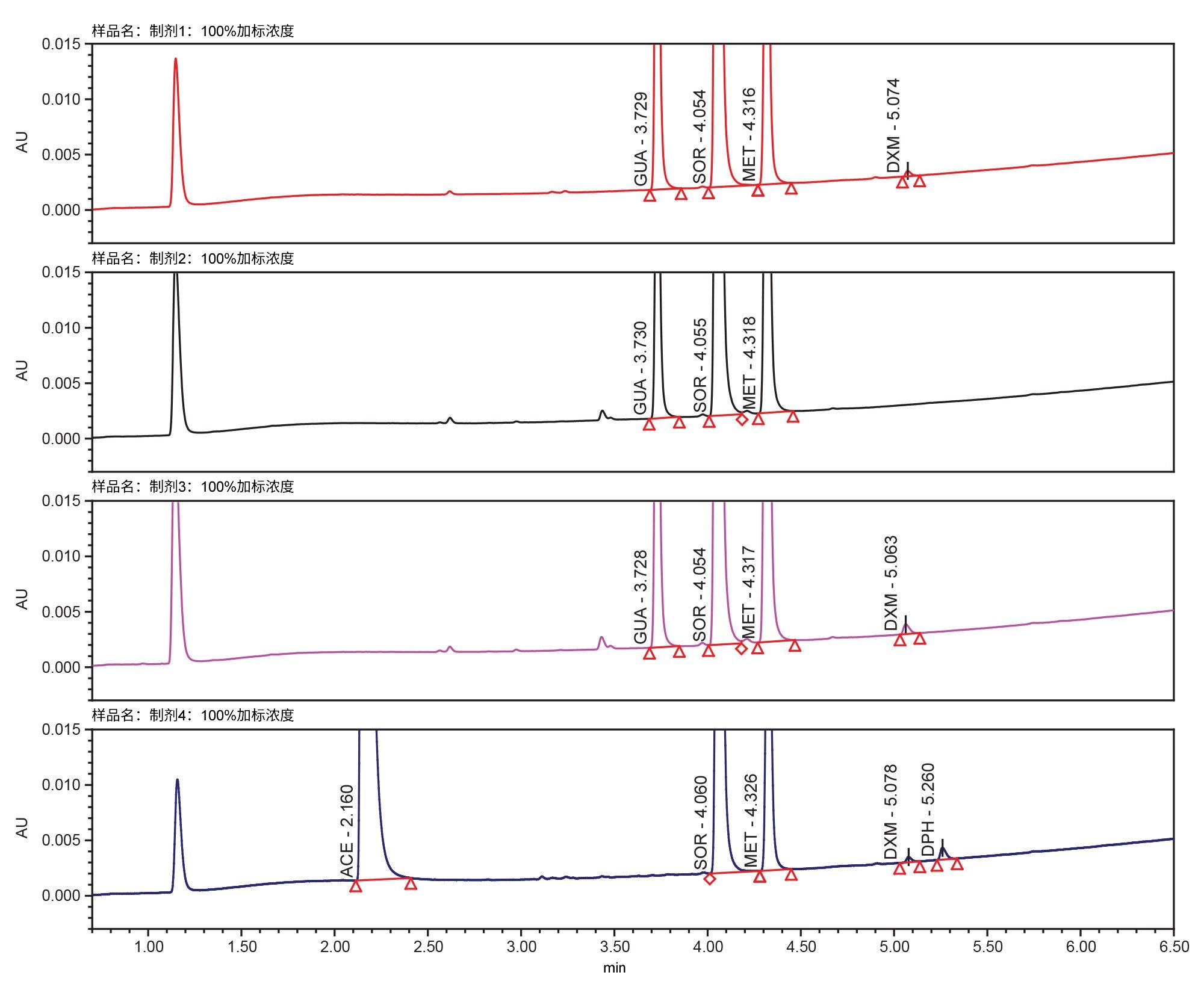
我们使用添加四种不同浓度山梨酸钾的所有四种制剂测试了最终方法,分别是:不添加、添加20%、50%和100%。在所有添加浓度下,所有制剂都具有可接受的分离度和色谱特性。制剂1在各加标浓度下的示例色谱图见图6。图7显示了所有制剂中添加100%山梨酸钾的结果。对于所有制剂,在任何山梨酸钾加标浓度下,所有API(包括关键化合物对)的分离度均未下降。在任何加标浓度的任何制剂中,所有API的保留时间、峰面积和拖尾因子均无显著变化。
峰纯度测试对于任何方法都很重要,尤其是在处理包含各种辅料的制剂时,因为共洗脱会导致结果不准确。由于这些止咳糖浆中存在大量未知峰,因此要避免发生共洗脱非常困难。使用UV分析完成峰纯度测试10。 本研究检测了API以及辅料山梨酸钾和对羟基苯甲酸甲酯。结果表明,所有纯度角均小于纯度阈值,证明具有光谱同质性,可以表明峰纯度。
结论
本研究开发出一种分离去氧肾上腺素、对乙酰氨基酚、琥珀酸多西拉敏、愈创甘油醚、右美沙芬和苯海拉明的单一方法。所有分析物均获得了所需的色谱特性,琥珀酸多西拉敏除外,其拖尾程度超出预期,但并未导致方法重现性低于可接受水平。该方法能够分离一系列常见止咳糖浆中的所有API与辅料。我们使用来自PDA和Empower软件UV峰纯度测试工具的数据测试了峰纯度,结果显示,被测样品中的所有API均具有光谱同质性。在所有山梨酸钾加标浓度下,所有制剂的分离度均不受影响。
我们采用Arc Premier系统,并配备了四元溶剂管理器(QSM)、色谱柱管理器(CM)和溶剂选择阀,能够自动探索各种条件。可靠的Arc Premier系统和CORTECS色谱柱能够快速分离API化合物。实现这一点的同时保持流动相兼容质谱仪,以便使用QDa质谱检测器协助方法开发和峰鉴定。
随着USP <1220>“分析程序生命周期”和ICH Q14“分析程序开发”指导原则的发布,AQbD原则以及改进方法开发理念的优势得到更广泛的认可。Fusion QbD软件可协助用户设计和执行实验、分析数据和优化方法。该软件有助于确定CMP与CMA之间的关系,使用户能够识别影响方法质量的重要因素。在这些文档概述的方法开发工作流程中纳入AQbD原则有助于创建高质量方法。
参考资料
- Özdemir A, Aksoy H, Dinç E, Băleanud D, Dermişc S. Determination Of Guaifenesin And Dextromethorphan In A Cough Syrup By Hplc With Fluorometric Detection.Revue Roumaine de Chimie.2006;51(2): 117–122.
- Dinç-Zor Ş, Dönmez ÖA, Aşçı B, Pingo E. Chemometric Optimization of an Hplc Method for the Simultaneous Analysis of a Multi Component Drug Product by the Help of Central Composite Design. Microchemical Journal.2020;152(152).
- Eccles R. What is the Role of Over 100 Excipients in Over the Counter (OTC) Cough Medicines? Lung Journal.2020;198: 727–734.
- Maziarz M, Rainville P. Robust and Rapid Method Development for Analysis of Active Pharmaceutical Ingredients in Multi-Component Cold and Flu Medication.Waters Application Note. 720006523.
- ICH Harmonized Guidelines, Analytical Procedure Development Q14, March 2022.
- USP General Chapter, USP-NF <1220> Analytical Procedure Life Cycle, The United States Pharmacopeia Convention, Official May 2022.
- USP Stage 4 Harmonization, USP-NF <621>Chromatography, The United States Pharmacopeia Convention, Official December 2022.
- Yuliana T, Gustin SSN, Alamsyah A, Budiman S, Hardian A, Yun YF, et al.HPLC Method for Simultaneous Determination of Dextromethorphan Hydrobromide, Chlorpheniramine Maleate and Potassium Sorbate in Cough Syrup.IOP Conference Series: Materials Science and Engineering.2021;1115(1).
- Grumbach E, Diehl D, Mazzeo J. Quantitation of Over the Counter Cold Medicine Formulations using UPLC Technology.Waters Application Note. 720002005. 2007.
- Maziarz M. 使用Empower CDS软件验证色谱峰的光谱纯度.沃特世应用纪要. 720006582ZH. 2019.
720007957ZH,2023年7月