使用BioAccord™系统和waters_connect™ Intact Mass™应用程序简化合成肽在强制降解条件下所产生杂质的LC-MS分析
摘要
在本应用纪要中,我们使用了一种符合法规要求的自动化工作流程来分析合成肽及其杂质。waters_connect信息学平台中的Intact Mass应用程序能够支持API(活性产品成分)及其杂质的检测和相对定量。简化工作流程的一个显著优势是,可以通过在处理方法中添加或删除目标质量数来实现靶向和非靶向数据处理。Intact Mass应用程序能够帮助科学家获得质量数信息,确认生产出正确的肽,并且支持对检出的杂质进行相对定量。
优势
- 使用waters_connect™ Intact Mass应用程序简化合成肽及其杂质的质量数确认和相对定量的LC-MS工作流程
- 支持靶向或非靶向杂质定量
- 内置阈值和通过/失败标准,确保优质数据质量和可信度,从而对合成肽的安全性和有效性进行快速评估
简介
肽类治疗药物是含有不到一百个氨基酸的氨基酸聚合物1。 这是市场上常见的一类生物治疗药物,因为它们的毒性相对较低、生物选择性高且具有治疗多种疾病的潜力2-3。 与其他获得FDA批准的生物药物类似,合成肽监管备案需要足够的数据来说明药物生产的一致性、有效性、效价和安全性。药物在生产过程和储存过程中会产生杂质。
通常使用搭配UV检测的液相色谱法,在鉴定出这些杂质并评估风险后评估肽杂质概况。LC-MS仪器和相关的数据处理软件使科学家能够使用愈加简单和自动化的分析工作流程来鉴定和定量API及其杂质。本应用纪要重点介绍近期开发的waters_connect Intact Mass应用程序在简化合成肽分析方面的性能。所用的数据处理工作流程可以根据生物分子的去卷积精确质量数自动分配生物分子,并使用来自光学或MS数据通道的积分峰面积定量各组分。该应用程序可以对分析物进行靶向(按质量数预先定义)和非靶向分析,以完成确证和杂质监测。
为说明该应用程序软件的功能,我们选择艾塞那肽作为测试分子。艾塞那肽是一种胰高血糖素样肽-1 (GLP-1)类似物,含有39个氨基酸残基。它是一种合成肽,用于治疗II型糖尿病。本应用纪要中所示为经过强制降解处理的艾塞那肽样品数据,这是一种用于常规和加速稳定性测试的技术。使用BioAccord™ LC-MS系统收集数据,该系统的操作也受控于waters_connect操作系统。在这个符合法规要求且网络可扩展的信息学平台中,从数据采集到结果报告的全套自动化工作流程能够集中完成。这些结果凸显出waters_connect和Intact Mass应用程序的性能和功能,可用于合成肽在整个产品生命周期的分析。
实验
样品描述
强制降解样品的制备:艾塞那肽购自USP(美国药典委员会,马里兰州罗克维尔)。将样品溶解在3.0 mL的milli-Q水中,制成0.9 mg/mL的溶液。用pH 7.5的100 mM Tris缓冲液将浓度调节至0.5 mg/mL,获得六份稀释样品。罩住其中三份样品,避光,在37 °C下温育2-4天。第二组等分试样在室温下温育,避光,温育相同时间。在温育期结束时,两组样品均用0.1%甲酸稀释至终浓度0.1 mg/mL,以备LC-MS分析。柱上进样体积为1 µL。
艾塞那肽序列信息
HGEGTFTSDL SKQMEEEAVR LFIEWLKNGG PSSGAPPPS-NH2
单同位素质量数:4184.02731 Da
平均质量数:4186.57188 Da
LC-MS系统适用性分析:将MassPREP™肽混合物(P/N: 186002337)溶解在100.0 µL的0.1%甲酸中。进样体积为1 µL。选择用于监测的肽及其中性质量数信息如下所示。
|
肽名称: |
缓激肽、血管紧张素II、血管紧张素I、肾素底物、烯醇化酶T35 |
|
分子量: |
1059.5613、1045.5345、1295.6775、1757.9253、1871.9604 Da |
|
相对定量: |
峰面积/总响应/排除原始 |
|
LC最小峰面积: |
5% |
|
杂质的通过/警告/失败阈值: |
5%/2%/1% |
|
强度阈值(最小值): |
(最大峰的)10% |
方法条件
|
液相色谱条件 |
|
|
液相色谱系统: |
ACQUITY™ Premier系统 |
|
检测条件: |
TUV (214 nm),MS |
|
样品瓶: |
采用MaxPeak™ HPS的QuanRecovery (P/N: 186009186) |
|
色谱柱: |
ACQUITY Premier CSH C18肽分析专用柱, 1.7 µm, 130 Å, 2.1 x 100 mm (P/N: 186009488) |
|
柱温: |
60 °C |
|
样品温度: |
6 °C |
|
进样体积: |
5 µL |
|
流速: |
0.25 mL/min |
|
流动相A: |
0.1%甲酸水溶液 |
|
流动相B: |
0.1%甲酸的乙腈溶液 |
|
梯度: |
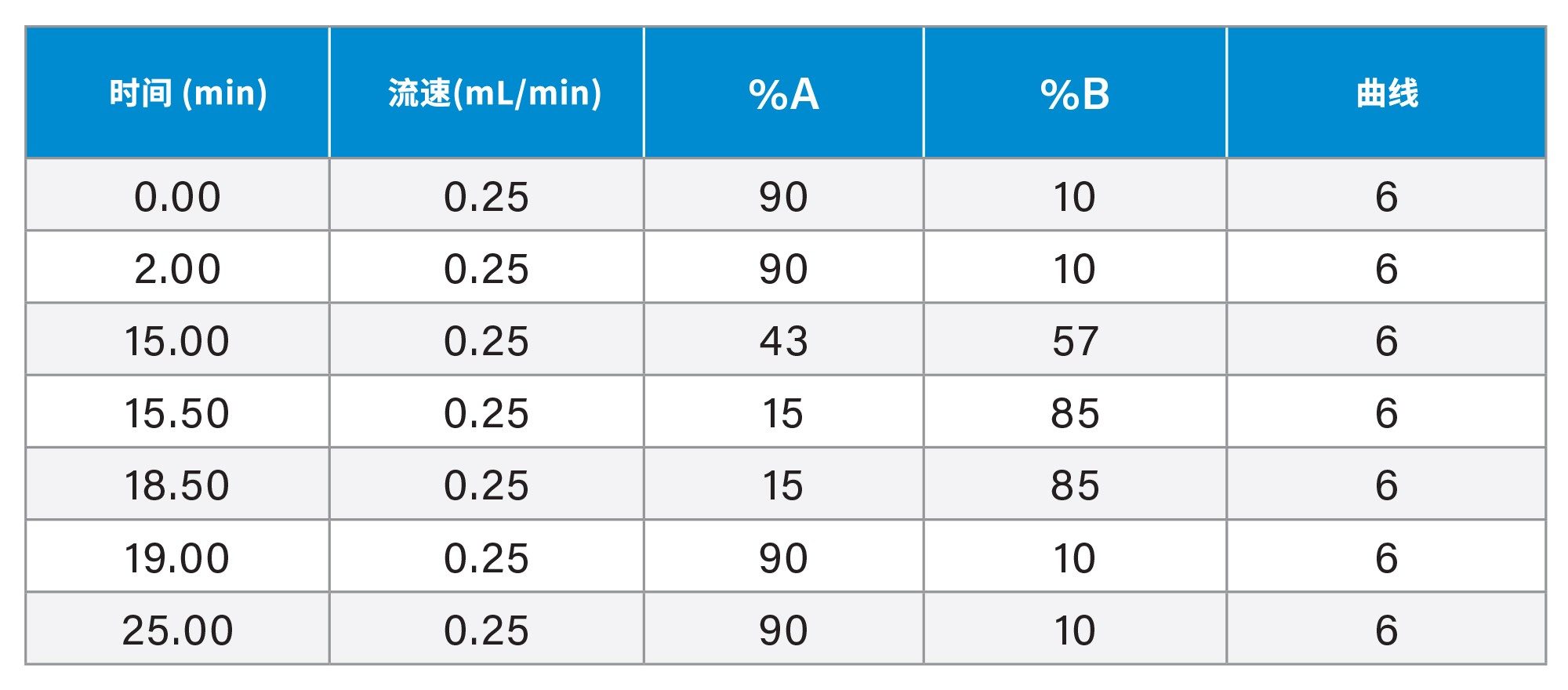
10%流动相B保持2 min,95%流动相B保持13 min,85%流动相B保持2 min,90%流动相B保持6 min |
梯度表
质谱条件
|
质谱系统: |
搭载ACQUITY Premier产品的BioAccord系统 |
|
电离模式: |
ESI+(包括碎片的MS扫描) |
|
采集范围: |
m/z 50-2000 |
|
毛细管电压: |
1.2 kV |
|
碰撞能量: |
60-120 V |
|
锥孔电压: |
20 V |
信息学工具
|
数据处理应用程序: |
Intact Mass应用程序1.2版 |
|
信息学平台: |
waters_connect v2.0 |
选择的Intact Mass应用程序处理参数
|
去卷积方法: |
自动 |
|
去卷积的最大峰数: |
10 |
|
LC最小峰面积: |
1 |
|
1-15 kDa算法: |
BayesSpray |
|
输出质量数: |
单同位素 |
|
生物分子类型: |
蛋白质 |
|
相对定量: |
面积、最大响应、排除原始 |
|
指定强度阈值(最小值): |
最强峰的0.1% |
结果与讨论
在使用BioAccord系统(ACQUITY UPLC-ToF MS)采集MS数据之前,通过反相分离采集LC-MS数据。UPLC系统和色谱柱均采用MaxPeak高性能表面(HPS)技术,可大幅减少肽与流路表面的非特异性相互作用。ACQUITY Premier反相色谱柱经证明可提高酸性肽的回收率,从而减少对色谱柱预平衡的需求并降低重复测定结果之间的差异性4,5。 在ACQUITY Premier CSH C18肽分析专用柱上使用15分钟梯度分离样品。
有研究表明,艾塞那肽容易因pH值变化、热处理和光照而发生化学降解6。 为了生成含有与热降解过程相关的已知杂质的样品,我们将一半的艾塞那肽等分试样在高温下温育2-4天(pH 7.5)。在温育期结束时对样品进行LC-MS分析。热降解样品的总离子流色谱图(TIC)如图1A所示。左上角的色谱图提取区域显示了艾塞那肽的主峰和几种潜在的降解产物(1–5)。
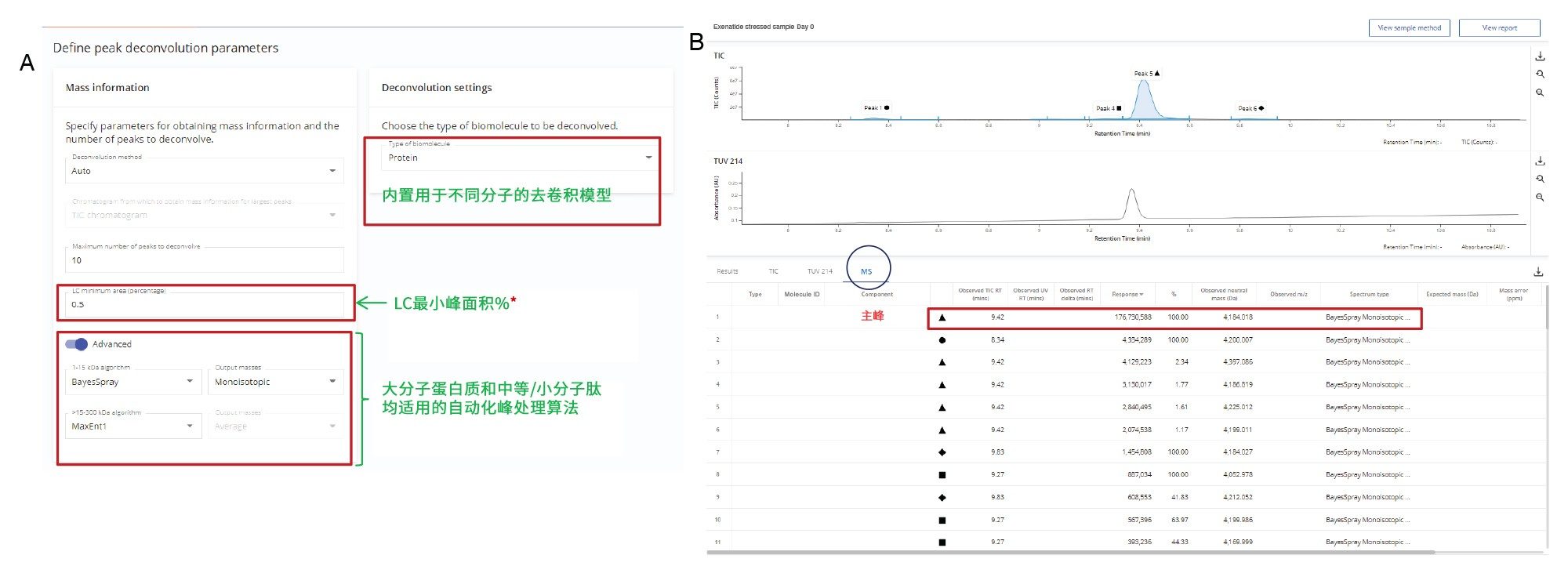
对初始的艾塞那肽LC-MS数据执行非靶向分析(没有根据质量数搜索的组分),来分配API及其杂质峰,如图1B所示。在分析方法中为每次进样分配预期质量数,以建立单独的目标质量数用于后续分析。对TIC中峰面积大于0.5%的峰(相对于所有峰的总峰面积计算)的每个累加质谱图进行电荷去卷积,以获得中性质量数信息。Intact Mass应用程序可以根据分析物的m/z谱(例如,同位素分离和未分离的谱图区域)自动调整电荷去卷积设置。对艾塞那肽使用的电荷去卷积设置列于方法的“Define Deconvolution Parameters”(定义去卷积参数)部分的“biomolecule”(生物分子)下(图2A),本研究使用“Protein”(蛋白质)分子的精细同位素模型。选择BayesSpray算法为质量数在1–15,000 Da之间的分子提供单同位素去卷积结果,因为合成艾塞那肽的MW为4184.0273 Da。
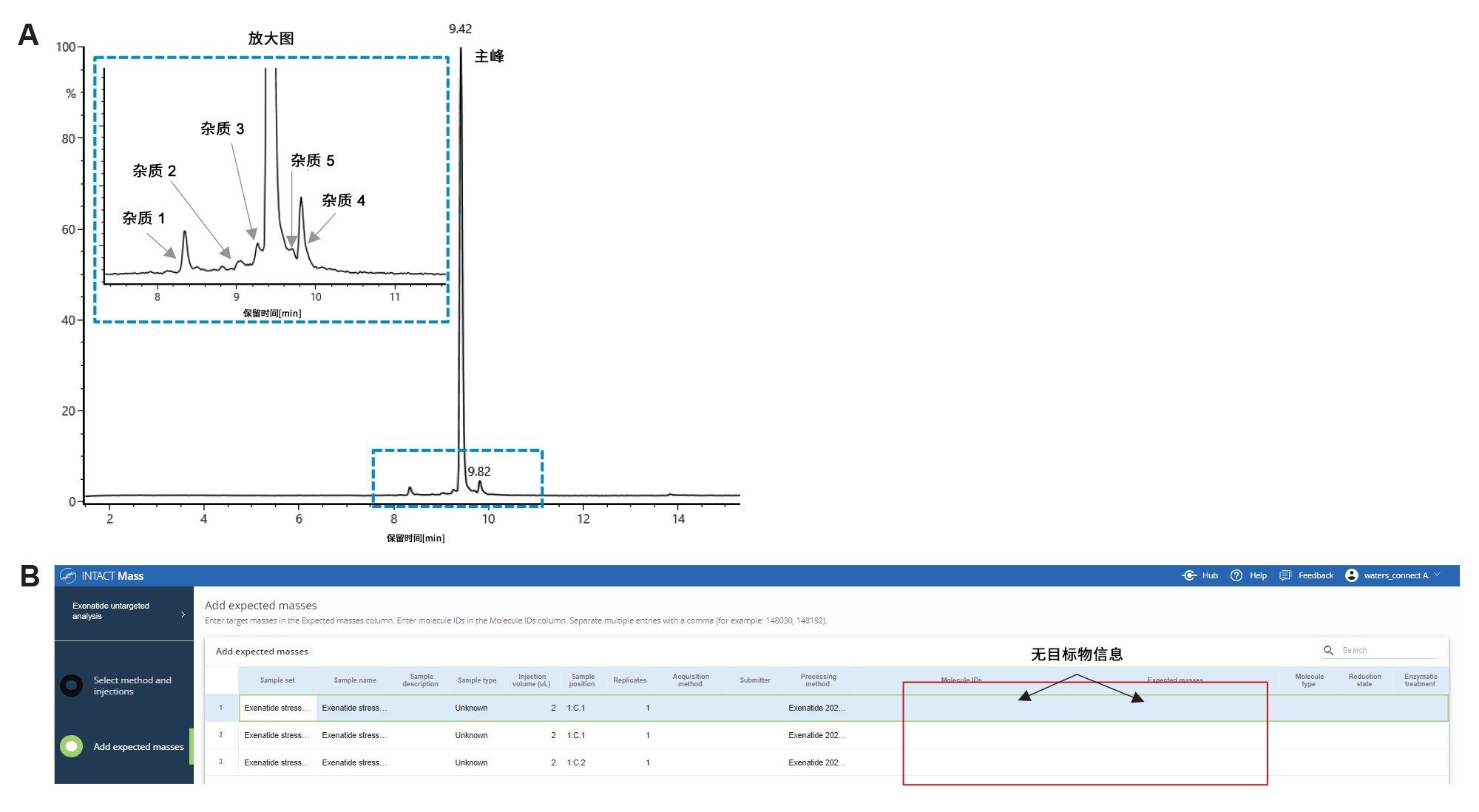
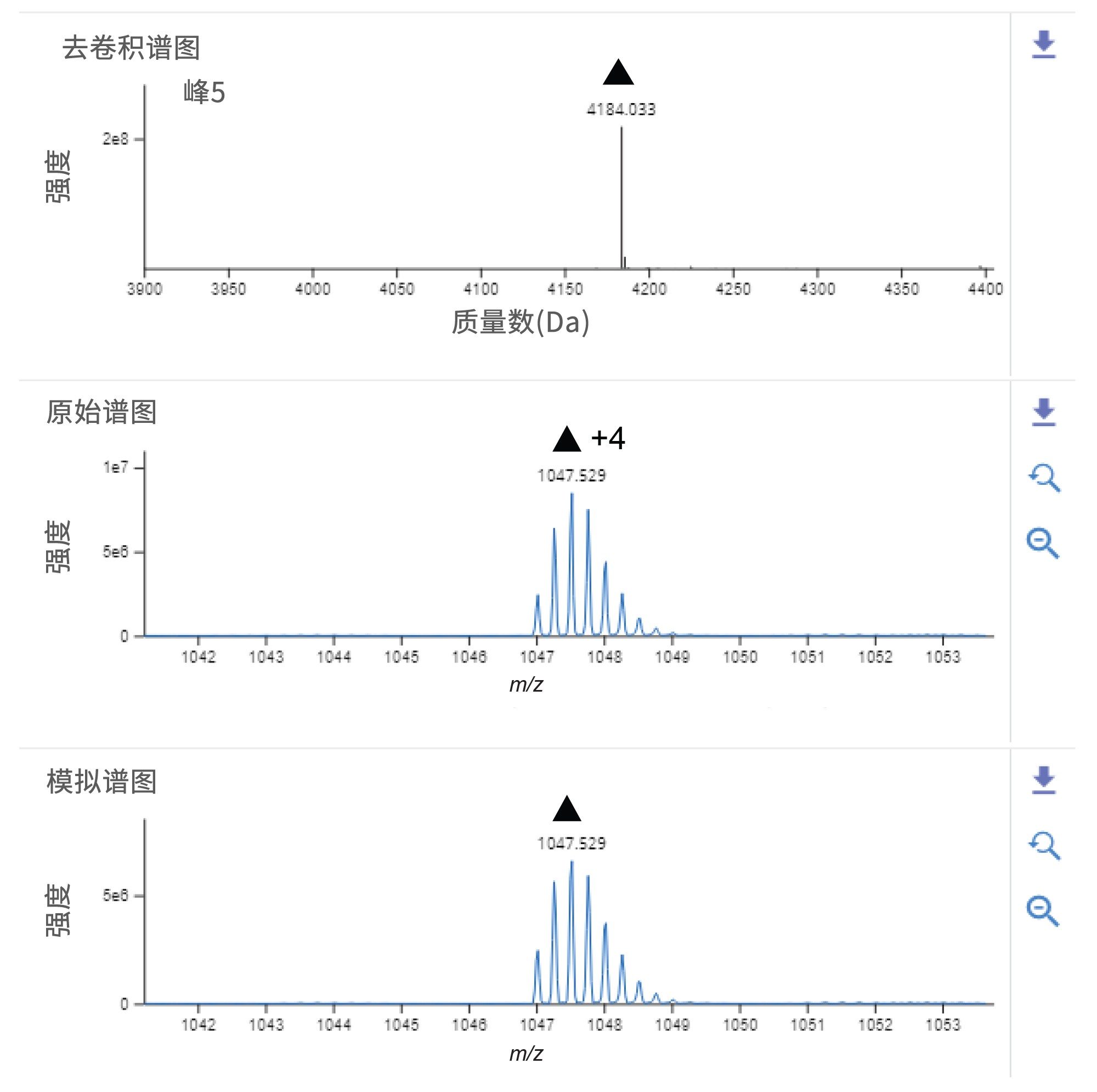
图2B显示了艾塞那肽的总离子流色谱图(TIC),峰5是最强色谱峰,在9.42分钟洗脱。去卷积数据确定了基峰的中性质量数为4184.018 Da,MS响应为1.7E8。观察到该峰的主要电荷态为+4和+5(图3)。图3显示,非靶向分析所得的最大峰,其数据与艾塞那肽的理论单同位素质量数相匹配,质量精度在5 ppm以内(质量误差 = -2.2 ppm)。
除了API主峰的质量数确认外,非靶向分析还提供了一种简单直接的方法来为色谱图中的未知杂质峰分配质量数。随后便可在靶向分析中指定这些杂质(图4A),将未知物峰的质量数与包含单个或多个修饰的艾塞那肽质量数相匹配。案例研究中使用的修饰是根据从非靶向分析数据计算的质量数偏移(与API的质量数差)确定的。修饰列表包括:与合成过程相关的潜在杂质,以及由强制降解条件导致的肽降解(根据第4天强制降解样品的数据)。这些修饰有氧化、脱酰胺、甲硫氨酸缺失(desMet)、天冬酰胺(Asn)的琥珀酰亚胺修饰,以及聚集体/二聚体形成(图4B)。加入艾塞那肽的中性质量数作为额外的修饰,以靶向因聚集所致的杂质峰:艾塞那肽的多聚体峰,这是一种由于热降解产生的常见杂质6。 如图4B所示,每个修饰都清楚地标记以确认杂质状态。Intact Mass应用程序中内嵌的科学库通常用于生成修饰列表。在强制降解样品(第2天热降解)中鉴定的杂质如图5所示。分析结果指出,丰度最高的杂质是氧化、脱酰胺琥珀酰亚胺修饰和甲硫氨酸损失。鉴定每个修饰的质量数误差均≤10 ppm,与相对丰度无关。本文报告的数据是基于TIC,不过,TIC和光学(UV)色谱图均可用于峰鉴定和定量。
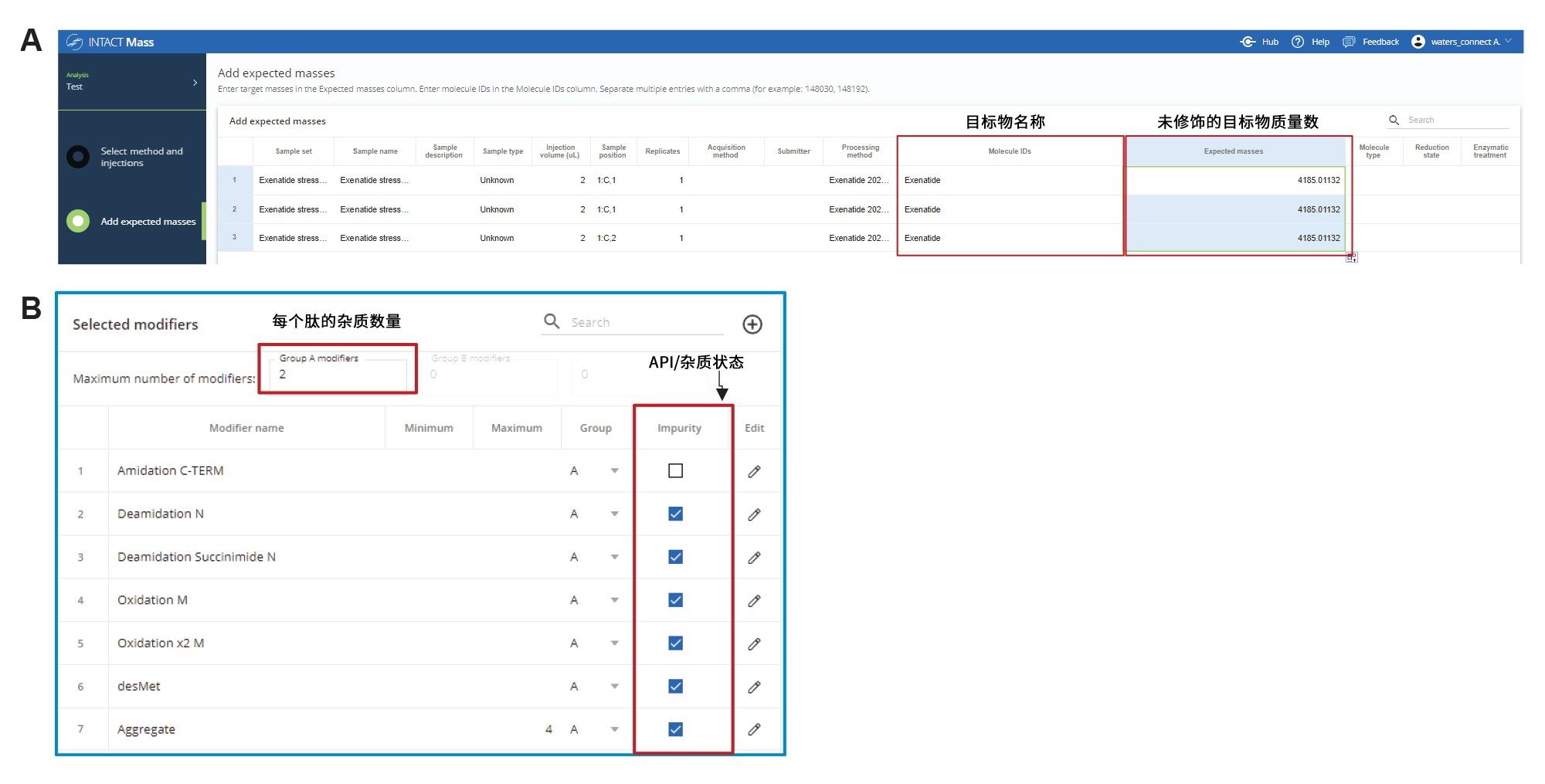
B) 每次进样都设置为非靶向分析。
API纯度和杂质定量
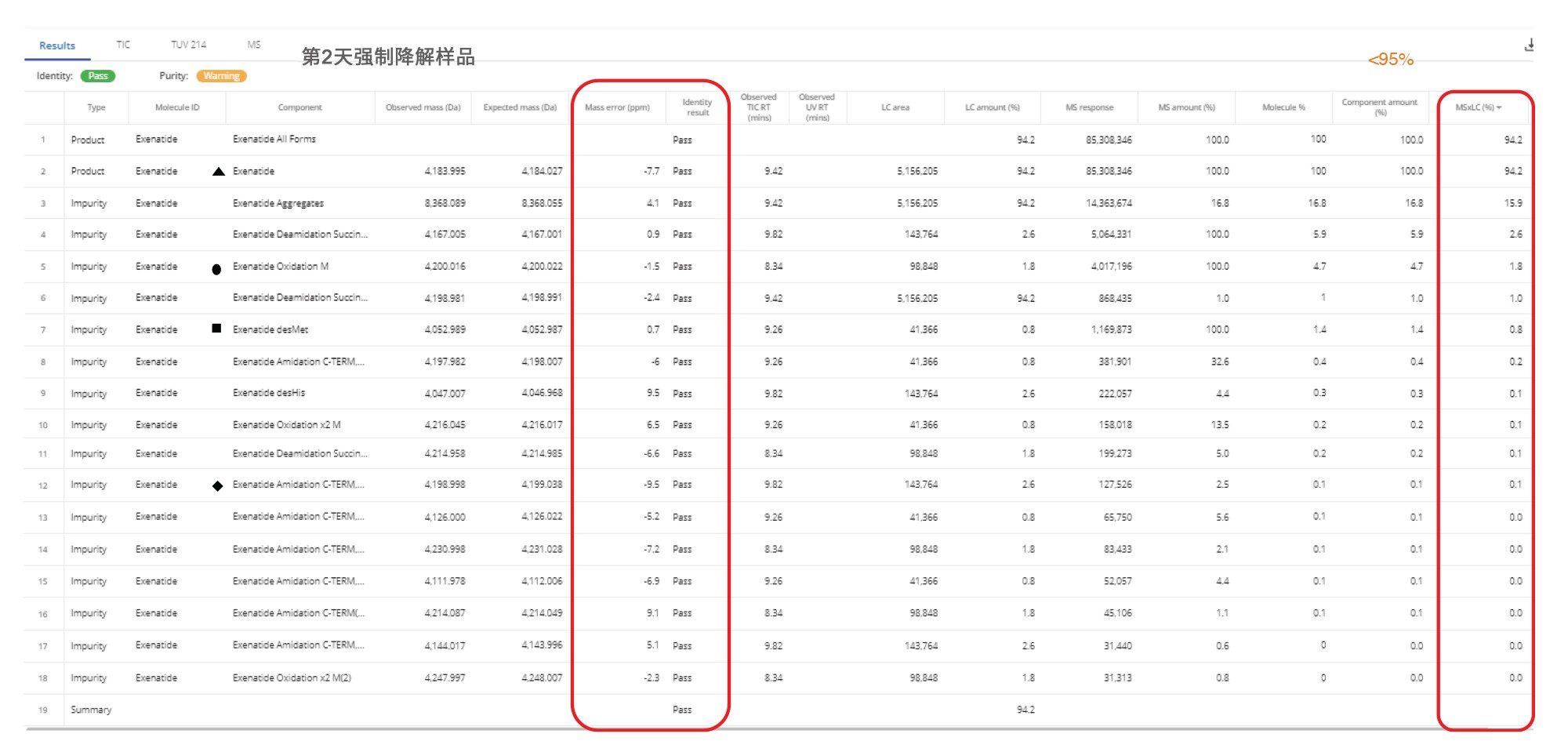
确认API杂质归属后通常进行药品(DP)的纯度评估。肽纯度水平由以下公式确定:肽纯度百分比 = [(Area UV 220nm DP)/ (Area UV 220nm all peaks)] *100;其中:Area UV 220 UV nm DP是在220 nm波长下监测的LC色谱图中目标肽的峰面积,Area UV 220 nm all peaks是所有峰的峰面积之和。光学检测采用相同的公式,也提供了基于纯度计算MS响应(TIC)的示例数据。图5显示了强制降解样品(高温下四天)的纯度百分比。在纯度计算中,将C-端酰胺化与原型艾塞那肽的MS响应组合在一起,以获得药品的总纯度百分比。C-端酰胺化是在合成肽中观察到的一种常见修饰,可提高肽的稳定性。
与API纯度的计算方式一样,Intact Mass应用程序使用TIC或UV谱图中的峰面积来计算杂质的相对定量。此外,杂质的丰度百分比(%)可以根据峰面积或峰高与所有峰的总响应或丰度最高的峰响应之比来计算。第4天的强制降解杂质使用杂质的峰面积与丰度最高的峰的峰面积之比来计算。实施通过/失败标准来展示内置的质量控制功能。由于UV谱图在甲酸流动相条件下表现出低信号,我们使用TIC来报告定量值。使用较低含量的TFA作为离子对试剂有利于获得灵敏的UV信号,定量时应首选UV色谱图,但这种方法需要更高的载样量来克服TFA引发的电喷雾信号抑制。
FDA针对合成肽药物发布的最新指南要求对超过原料药/API 0.5%丰度的杂质进行相对定量7。 因此,本案例研究选择0.5%作为最低定量阈值。示例数据仅报告了等于或大于0.5%丰度的峰。丰度最高的杂质是艾塞那肽的聚集体(二聚体),测得的丰度为16.8%(第2天的强制降解样品),并且在参考样品(第0天)中完全不存在,这证实了艾塞那肽对高pH值和热效应的敏感性。相对于主峰,其他主要杂质为氧化(4.7%)、甲硫氨酸损失(desMet) (1.4%)和天冬酰胺琥珀酰亚胺(5.9%)。
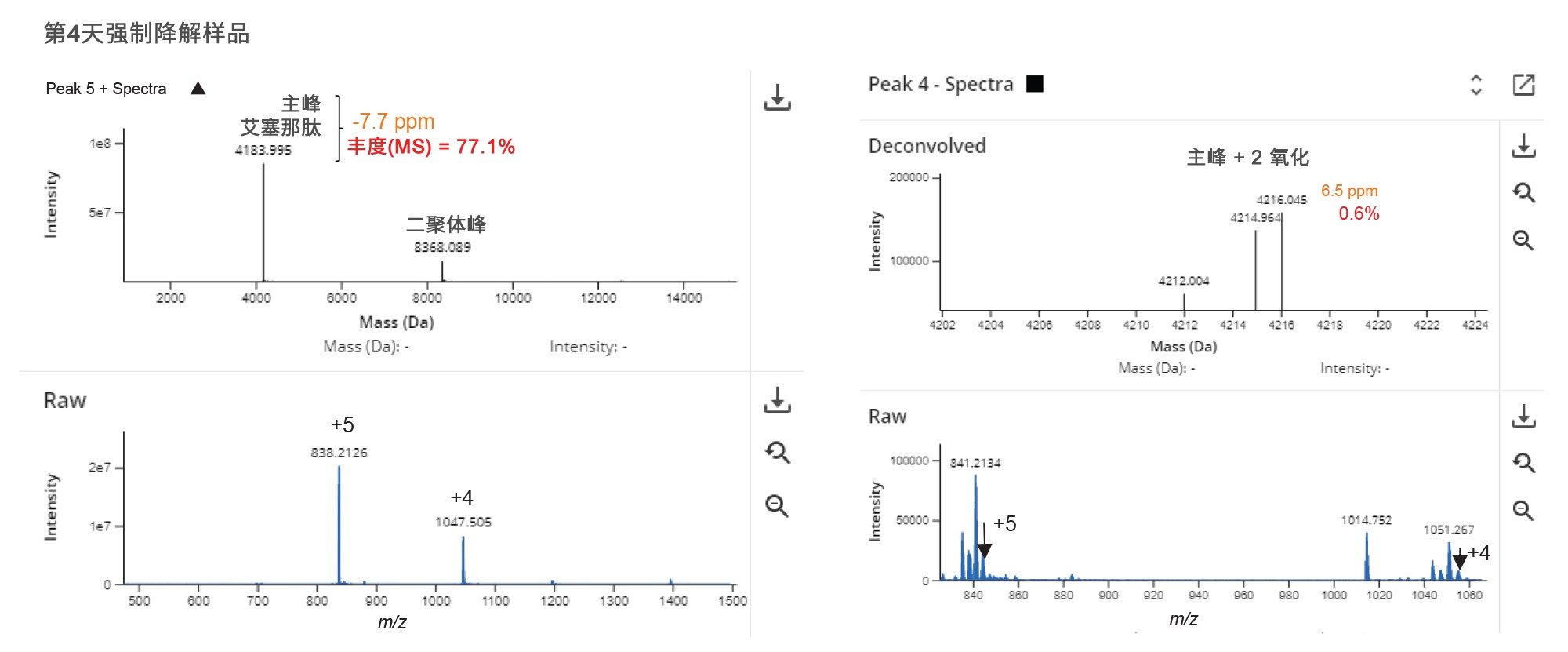
图5中的结果表显示了各种其他测量值:例如产品纯度、分配的修饰、峰保留时间、MW、质量误差、定量和通过/未通过状态。由于API纯度低于设置的预期值95%,因此标记了艾塞那肽强制降解样品的纯度。在第4天强制降解样品中鉴定出的最低丰度杂质(0.8%)具有艾塞那肽的双氧化峰,质量精度为6.5 ppm(图6)。该峰与去卷积MS谱图中鉴定的所有峰的总MS响应相比丰度约为0.6%,对检出的主要和次要杂质显示了高质量结果。
结论
- 使用waters_connect信息学平台内的BioAccord LC-MS系统完成合成肽质量数确认和杂质分析的自动化LC-MS工作流程
- 艾塞那肽的强制降解研究用于说明API确证、纯度评估以及杂质鉴定和定量的过程。本文介绍了系统适用性测试、可选择的阈值和通过/失败标准等质量特性
- 为初始峰分配和库的生成执行初始非靶向杂质表征,随后进行后续靶向监测的实用程序,被证明可以为分析人员提供灵活性和可用性,用于评估产品质量属性,并利用新产品知识快速改进方法
参考资料
- FDA; 2016b Guidance for Industry: Biosimilars: Questions and Answers Regarding Implementation of the Biologics Price Competition and Innovation Act of 2009; 2016.
- Mason, J. M., Design and development of peptides and peptide mimetics as antagonists for therapeutic intervention.Future Medicinal Chemistry 2010, 2 (12), 1813–1822.
- Pernot, M.; Vanderesse, R.; Frochot, C.; Guillemin, F.; Barberi-Heyob, M., Stability of peptides and therapeutic success in cancer.Expert Opinion on Drug Metabolism & Toxicology 2011, 7 (7), 793–802.
- Robert E. Birdsall, Jacob Kellett, Samantha Ippoliti, Nilini Ranbaduge, Matthew A. Lauber, Ying Qing Yu, Weibin Chen, Reducing Metal-ion Mediated Adsorption of Acidic Peptides in RPLC-Based Assays Using Hybrid Silica Chromatographic Surfaces, Journal of Chromatography B, 2021, 122700, ISSN 1570–0232
- Ranbaduge, N., Birdsall, R., Yu, Y.Q, Chen, W., 使⽤装配ACQUITY Premier产品的BioAccord系统改善肽的监测, 沃特世资料, 720007351ZH, 2021年8月.
- Benet A, Halseth T, Kang J, Kim A, Ackermann R, Srinivasan S, Schwendeman S, Schwendeman A. The Effects of pH and Excipients on Exenatide Stability in Solution.Pharmaceutics. 2021 Aug 16;13(8):1263.doi: 10.3390/pharmaceutics13081263.PMID: 34452224; PMCID: PMC8398870.
- FDA ANDAs for Certain Highly Purified Synthetic Peptide Drug Products That Refer to Listed Drugs of rDNA Origin; Food and Drug Administration: https:\\www.regulations.gov, 2017.
720007752ZH,2022年10月