萃取物、可浸出物和接触材料:离子淌度增强质谱库的宝贵优势
摘要
与默克集团合作,使用一组萃取物和可浸出物有证标准物质(CRM)混合物来制作超高效液相色谱离子淌度质谱(UPLC-IM-MS)谱库,包括保留时间、母离子、子离子m/z,以及ES+和ES-模式下的碰撞截面(CCS)值。与常规质谱库相比,离子淌度增强质谱库具有更高的累积特异性,有利于降低误检率并提高复杂基质样品鉴定的可信度。
使用UPLC™-IM-MS谱库执行非靶向筛查方法来筛查两种食品样品。使用萃取物和可浸出物(E&L)谱库鉴定普遍存在的塑料成分、天然成分和加标分析物。将实验结果与质谱库数据比较时,ΔCCS值在2%以内,保留时间差异不超过0.1分钟,保证了鉴定结果的可信度。在未观察到子离子的情况下,CCS值提高了鉴定结果的可信度。
对所生成的E&L谱库进行了验证,该谱库可以促进E&L鉴定的非靶向筛查过程。
优势
- 本研究生成了包含CCS值的萃取物和可浸出物离子淌度增强质谱库。与常规质谱库相比,该谱库具有更高的特异性
- 降低误检率并提高复杂基质样品鉴定的可信度
- 保留时间、母离子和子离子信息可应用于采用传统MS数据的分析
简介
越来越多的全球法规正在推动各行各业中E&L组分的鉴定和表征1-7。 产品包装或接触材料由多种化学品制成,可能含有聚合物和聚合物添加剂,例如抗氧化剂、紫外线稳定剂、滑爽剂和着色剂。这些化学品、相关杂质以及降解产物会迁移到消费品中,导致食品、药品和化妆品中增加不需要的潜在有害物质。人造产品应用的范围非常广,从简单的食品标签到回收包装、服装、药物递送系统和植入式医疗器械均有它的身影。典型的E&L分析工作流程最初从靶向筛查步骤开始。筛查工作基于组分谱库或数据库进行,即根据准确质量数、保留时间和子离子数据比对化合物。谱库质量对于实现可靠的筛查应用至关重要。工作流程的下一步是非靶向筛查,就是对所发现的任何未知组分进行后续表征。这一步通常复杂且耗时;但是,借助比较和解析软件工具可以加快进度。
四极杆飞行时间质量分析器(Q-ToF)等高分辨率质谱仪(HRMS)作为筛查工具应用越发普遍。使用非靶向“全谱图”数据采集,单次分析即可完成数千次检测,然后进行回顾性靶向数据分析。追求更高的样品通量是一个全球性的目标,人们对于提高时间效率和降低成本的要求推动了多类别化合物分析的发展。这种方法已被用于分析食品和环境样品,以及各种复杂样品基质中存在的有机污染物8–13。筛查方法的目的是快速检测并鉴定所考察样品中的目标化合物,同时尽可能降低误检率。借助化合物的实测特性,例如准确质量数、同位素模式和子离子谱图,可以应用适当的筛选条件来确定样品中是否存在相应的化合物。分析复杂基质时,单独使用这些特性来鉴定基质或分析物可能更具挑战性,需要采用额外的方法开发策略。离子淌度(IM)分离带来了一个额外的维度,有助于缓解此类分析难题,还能通过CCS进一步增加鉴定特异性。
UPLC-IMS包括离子淌度(MS分析之前的气相分离)和UPLC(中性物质分离)14,15。UPLC(秒)、IMS(毫秒)和飞行时间MS(微秒)的时间尺度符合复杂样品的高通量分析要求。淌度分离通过使用相对较弱的电场驱动离子包穿过惰性缓冲气体(氮气)来实现。如果使用了极化缓冲气体,离子和缓冲气体之间的碰撞次数会导致不同的漂移时间,这是离子大小、形状和电荷以及离子偶极矩的函数。离子淌度在CCS(一种补充性的鉴定指标)之外,还为LC(疏水性)和MS(m/z)提供了额外的分离维度。CCS提高鉴定特异性的效用已在多种应用中得到证明16–22,按照之前所述的质谱库生成策略23,使用UPLC-IM-MS对一组E&L化合物进行了表征。生成的谱库对串联质谱、ToF或IM分析均有帮助。采用的策略为所表征的分析物提供了保留时间(tr)、母离子、子离子和CCS数据。
在沃特世与默克集团的合作中,我们利用分析物定量所用的CRM混标,共同构建了一个E&L谱库。E&L化合物谱库已被用于两种食品的非靶向筛查。
实验
样品描述
食品基质:橙汁、黑加仑苹果汁的10:1 (H2O)稀释液,样品加标浓度100pg/µL。
- 样品ES+:邻苯二甲酸二(2-乙基)己酯、双酚A二(2,3-二羟基丙基)醚、双酚A二缩水甘油醚、邻苯二甲酸丁苄酯、双(4-氯苯基)砜、邻苯二甲酸二丁酯。
- 样品ES-:3,5-二叔丁基-4-羟基苯甲醇、双酚A、2,4-二叔丁基苯酚、2,6-二叔丁基苯酚、对苯二甲酸、3-(3,5-二叔丁基-4-羟基苯基)丙酸正十八烷酯。
所有标准品均由瑞士布克斯的Sigma-Aldrich(默克集团)提供。
方法条件
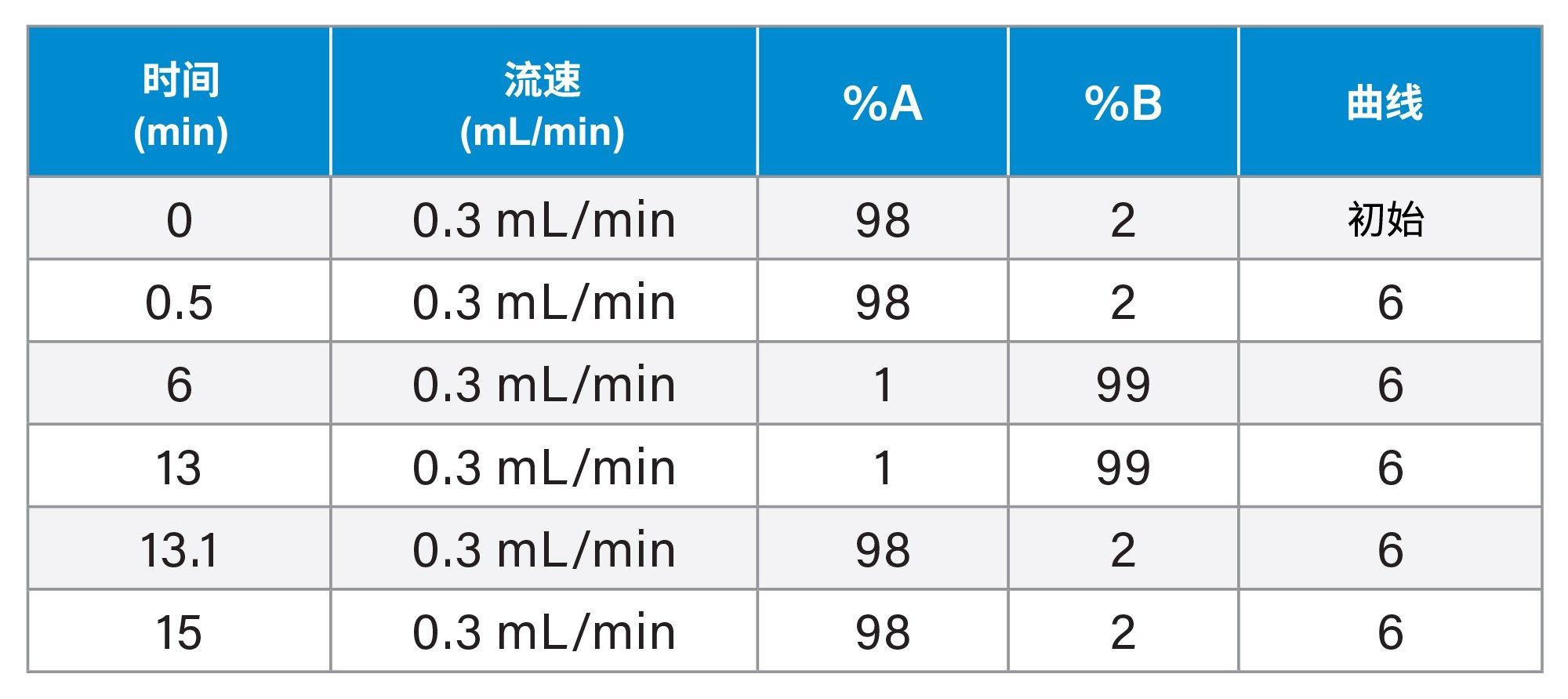
|
液相色谱条件 |
|
|
液相色谱系统: |
Waters ACQUITY™ UPLC I-Class系统 |
|
样品瓶: |
通过LCMS认证的12 × 32 mm螺口透明玻璃全回收样品瓶,配有盖子和预开槽PTFE/硅胶隔垫,容积1 mL (P/N: 600000671CV) |
|
色谱柱: |
ACQUITY Cortecs™ C18, 90 Å (1.6 µm, 2.1 x 100 mm)色谱柱 |
|
柱温: |
50 °C |
|
样品温度: |
6 °C |
|
进样体积: |
10 µL |
|
流速: |
0.3 mL/min |
|
流动相A: |
H2O + 1 mM醋酸铵(含0.1%甲酸,v/v) |
|
流动相B: |
甲醇 |
Gradient Table
|
质谱条件 |
|
|
质谱系统: |
SYNAPT™ XS |
|
电离模式: |
ES+/ES- |
|
采集范围: |
m/z 50–1200 |
|
采集速率: |
每秒10幅谱图 |
|
毛细管电压: |
1 kV/0.8 kV |
|
脱溶剂气温度: |
550 °C |
|
离子源温度: |
150 °C |
|
实时校正标准液: |
亮氨酸脑啡肽(m/z 556.2766) |
|
采集模式: |
HDMSE |
|
碰撞能量: |
碰撞能量梯度(20~40 eV/20~50 eV)。 |
|
IMS参数: |
缺省参数包括:T-Wave速度梯度=开始:1000 m/s,结束:300 m/s;T-Wave脉冲高度=40 V,在相应的气体池中使用氦气流180 mL和氮气流(缓冲气体)90 mL,使IM池压力达到约3.2 mBar。 |
|
校准: |
IMS/Tof校准试剂盒(P/N: 186008113)(沃特世公司,英国) |
结果与讨论
E&L分析领域非常广泛,且存在许多未知,但生成包含tr、母离子、子离子和CCS值的E&L库,为非靶向筛查分析提供了额外的特异性。普遍存在的污染给E&L分析带来挑战。本研究所采取的验证范围旨在验证谱库,并证明对其他鉴定的可信度。
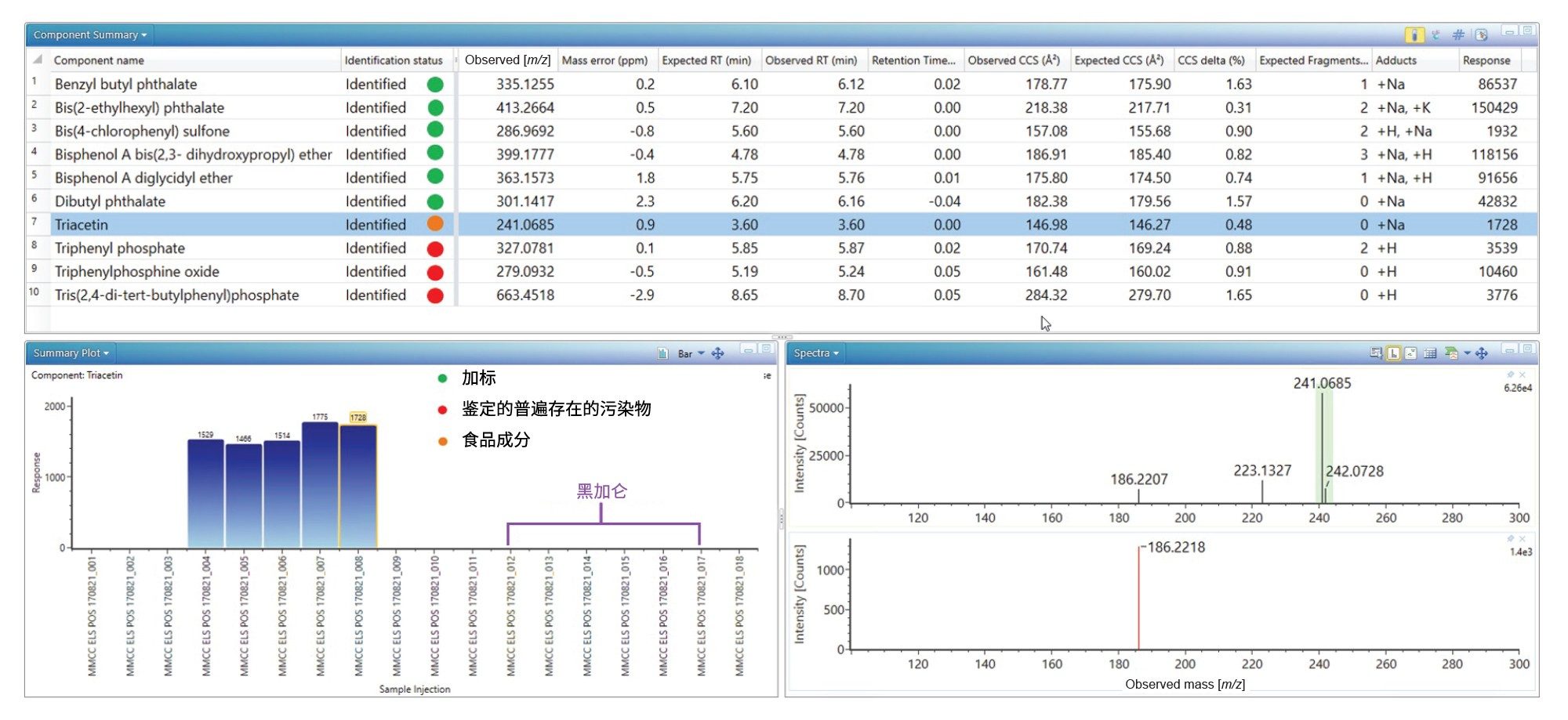
向两种食品(橙汁和黑加仑苹果汁)加入100 pg/µL的E&L标准品进行分析,验证生成的E&L库。UPLC-IM-MS ES+分析加标橙汁的相应结果如图1所示。图中已鉴定出加标的E&L分析物,观察到保留时间误差(<0.1 min)、质量精度(<5 ppm)、预期子离子计数(0–3)和Δ TWCCSN2 (< 2%)。还观察到[M+H]+、[M+Na]+和[M+K]+物质的组合。对于鉴定出的四种分析物,已确定两个TWCCSN2值,从而提高了特异性。在邻苯二甲酸二丁酯中没有观察到子离子,但可以使用CCS值作为一个额外的指标来提高鉴定的可信度。
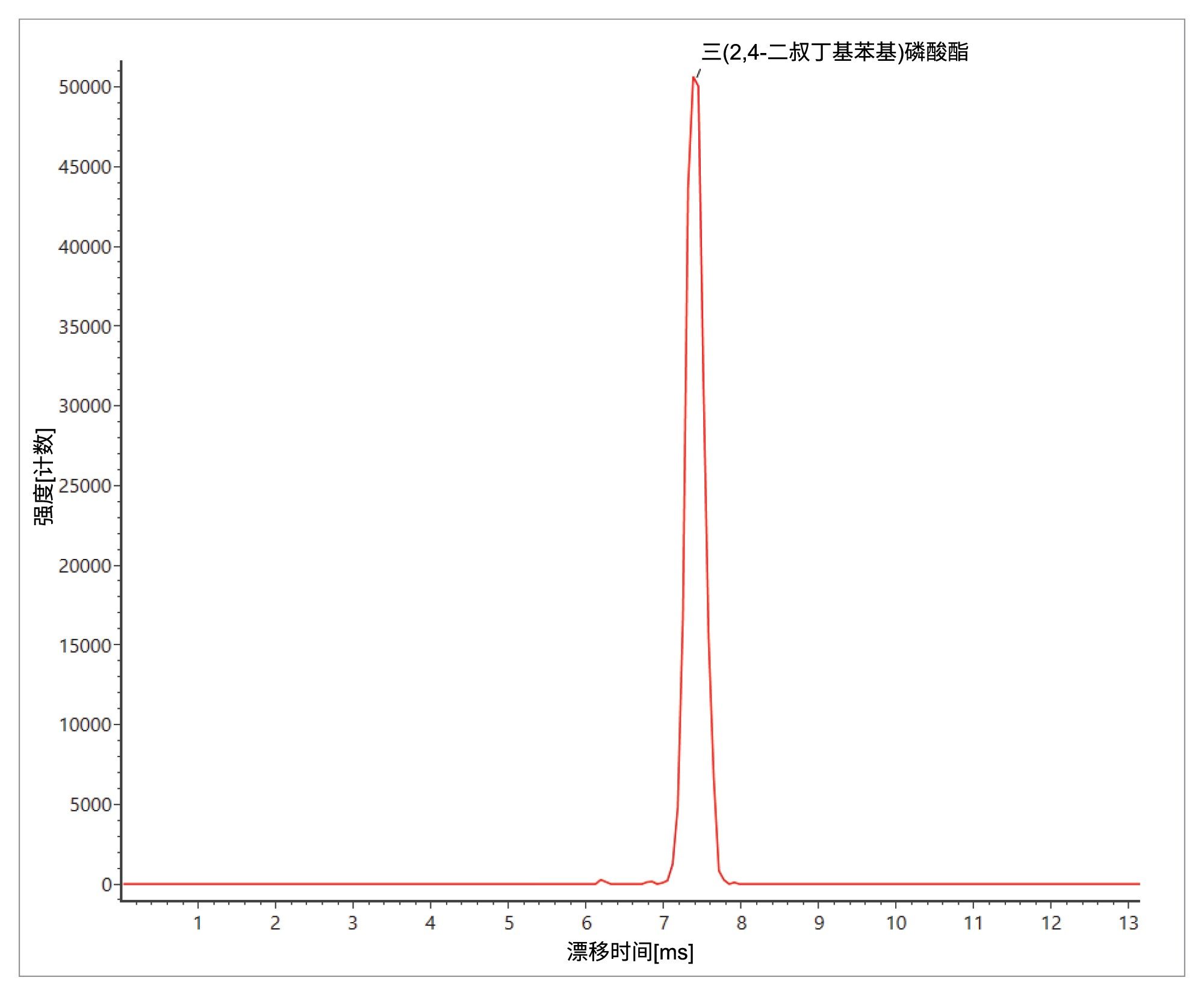
从图1可以看出,已检出三苯基氧化膦、磷酸三苯酯和三(2,4-二叔丁基苯基)磷酸酯,观察到保留时间误差(< 0.05 min)、质量精度(< 3 ppm)、预期子离子计数(0–2)和Δ TWCCSN2 (< 1.65%)。这些分析物是普遍存在的塑料成分污染物,在溶剂和基质空白样品中可以得到可靠鉴定24–25。此外,还检出并鉴定了三醋酸甘油酯,确定了保留时间误差(<0.0 min)、质量精度(0.9 ppm)、预期子离子计数(0)和Δ TWCCSN2 (0.5%)。三醋酸甘油酯的结果汇总图(见图1)显示,在橙汁食品中检测到该物质,但在空白样或黑加仑苹果汁中没有检测到。而食品标签上并未将三醋酸甘油酯指明为特定的食品添加剂。调查食品成分以合理解释所检出的三醋酸甘油酯时,重点关注被列为“木松香甘油酯乳化剂”的成分,这是柑橘味软饮料中为防止在分销期间发生沉淀分离而采用的乳化剂。三醋酸甘油酯是一种常见的食品添加剂(E1518),例如用作调味剂中的溶剂,分子式为C3H5(OCOCH3)3,被归为甘油三酯类物质,即甘油的三酯。木松香甘油酯是一种天然产物,从长叶松(pinus palustris)和湿地松(pinus elliottii)的树桩中收获,并提纯为饮料级增重剂。三醋酸甘油酯可能被检测为木松香的天然成分。
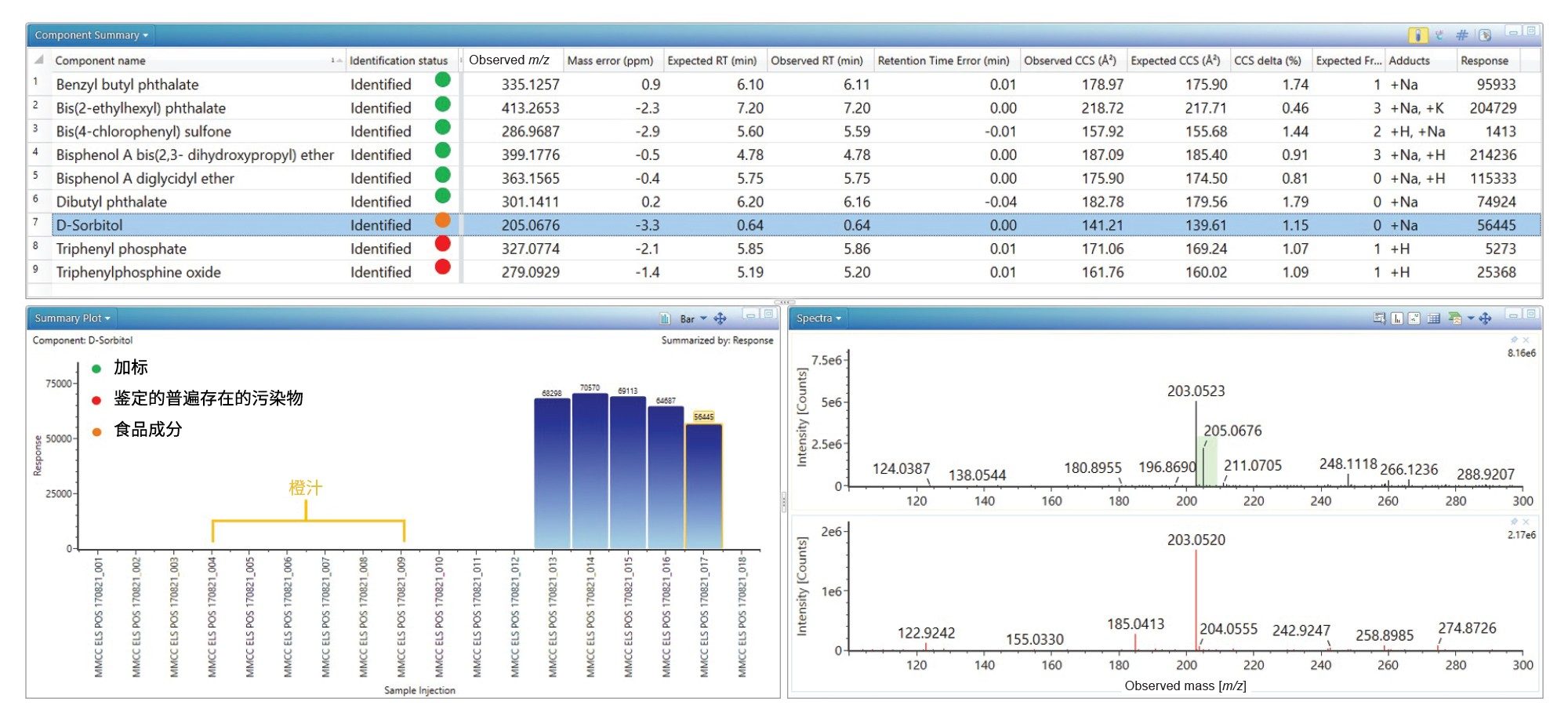
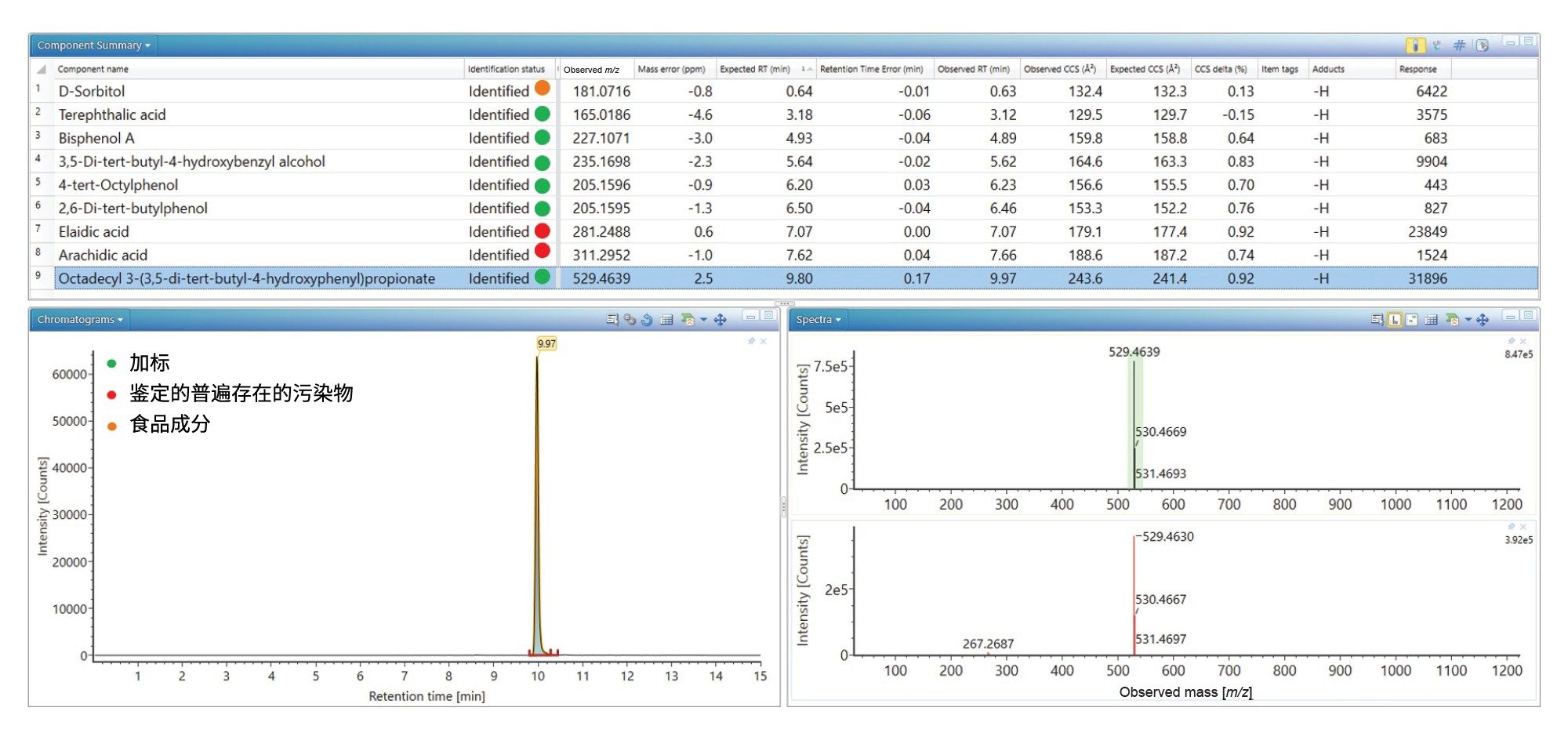
在黑加仑苹果汁中成功鉴定了加标分析物,普遍存在的塑料污染物也同样检出(见图2)。此外,还检出并鉴定了D-山梨醇,确定了保留时间误差(0.0 min)、质量精度(-3.3 ppm)、预期子离子计数(0)和Δ TWCCSN2 (1.15%)。在没有子离子的情况下,CCS值提供了一个额外的指标。D-山梨醇的结果汇总图(见图2)显示,在黑加仑苹果汁食品中检测到该物质,但在橙汁中没有检测到。而食品标签上并未将D-山梨醇指明为特定的食品添加剂。标签显示商品成分含有浓缩果汁(苹果9%,黑加仑1%),D-山梨醇作为一种天然产物存在于苹果和黑加仑中26。
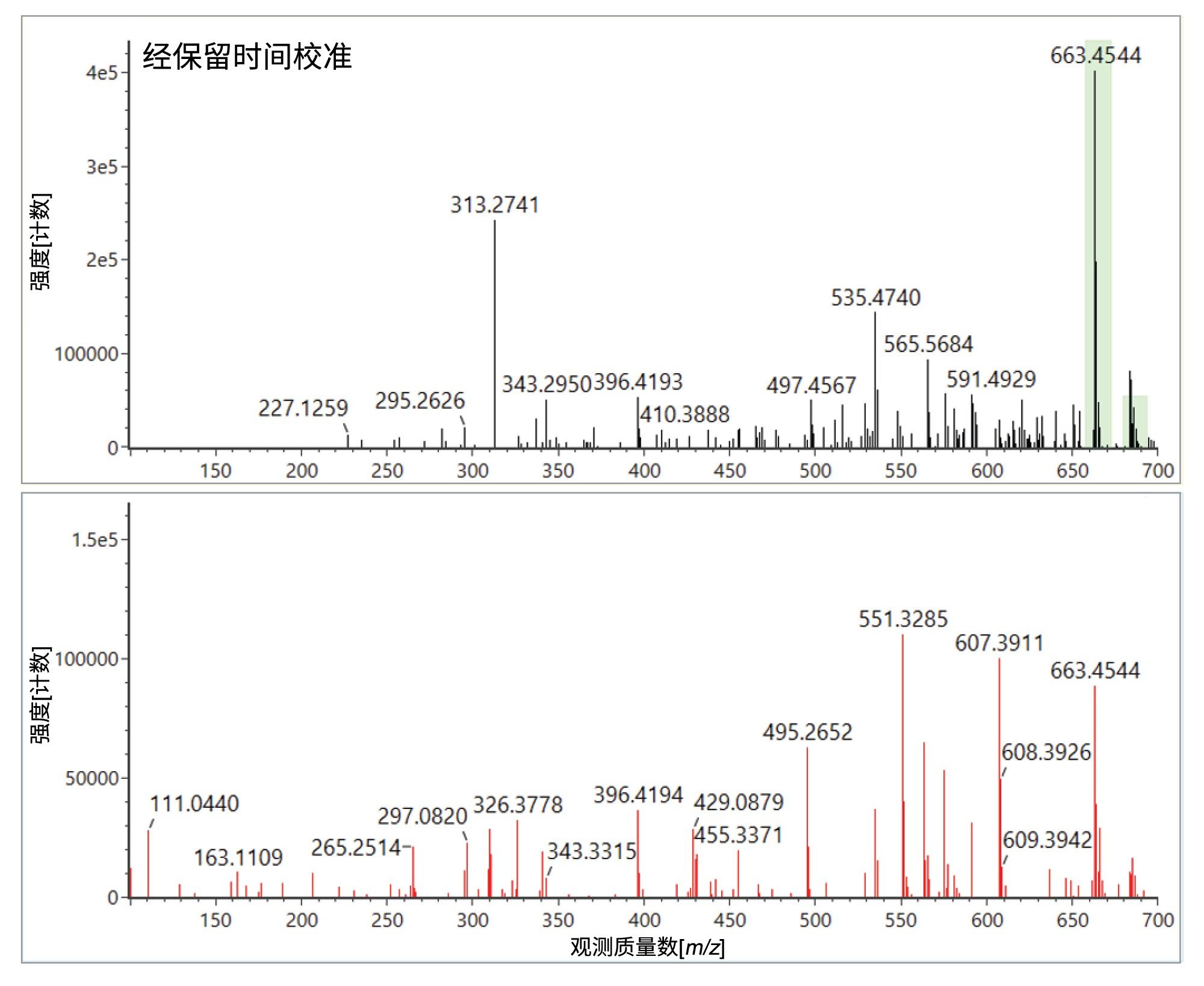
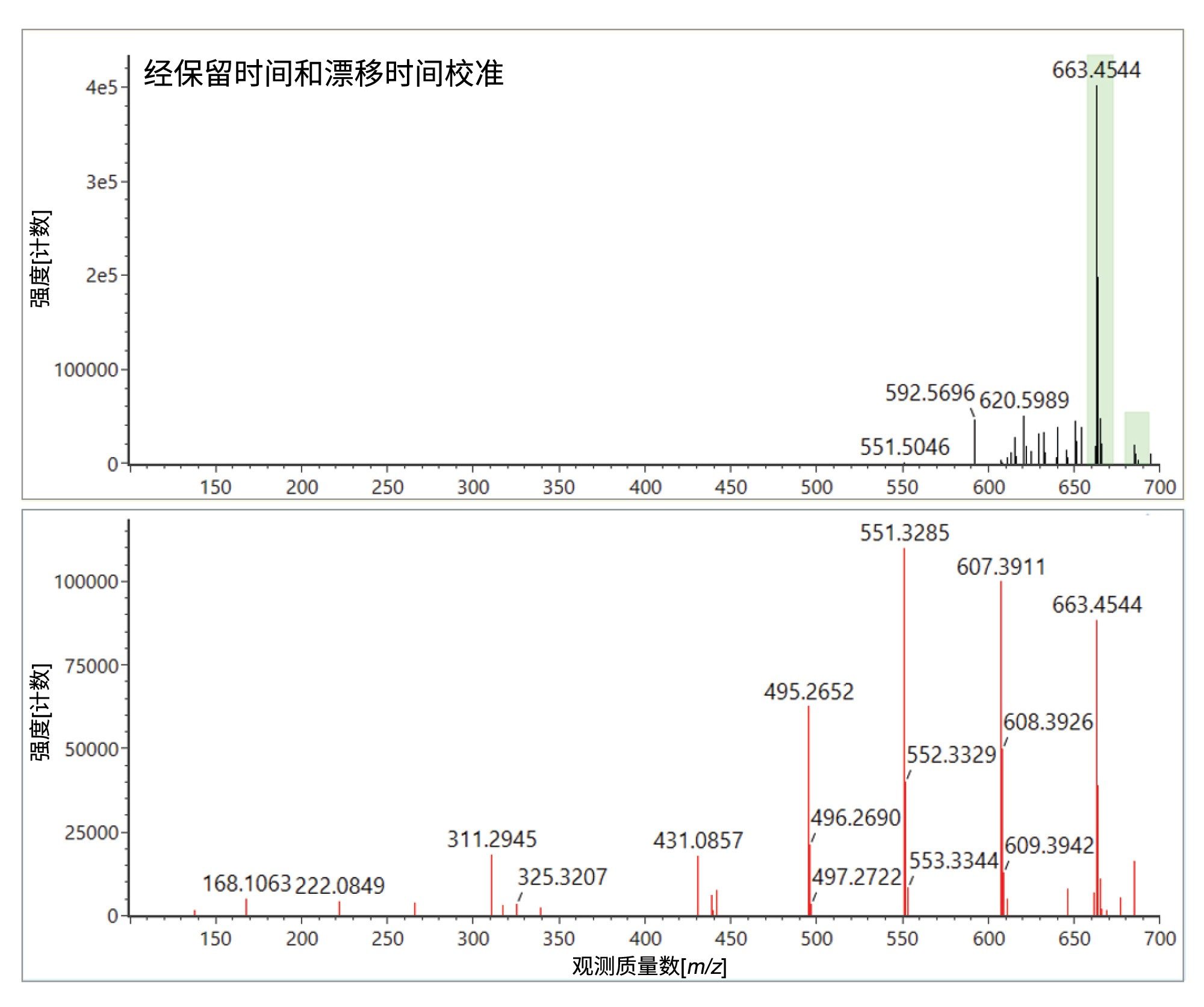
本研究还使用UPLC-IM-MS ES-分析进行了验证并成功鉴定了E&L加标分析物(见图4),观察到保留时间误差(<0.2 min)、质量精度(<5 ppm)、预期子离子计数(0–3)和Δ TWCCSN2 (< 1%)。D-山梨糖醇实现了双极性鉴定,还鉴定了脂肪酸(FA)、花生酸和反油酸。从结果汇总图很容易看出,反油酸在溶剂空白和基质空白中检测到高背景响应。脂肪酸被报告为溶剂中的污染物,也可能从实验室硬件/耗材中浸出27。但是,橙汁中反油酸的响应升高,表明检出了橙汁特有的成分,经鉴定为一种FA (C18)成分。柑橘类水果的脂肪酸成分包括油酸(C18:1)、硬脂酸(C18:0)和花生酸(C20:0)28–30。我们使用高纯度标准进行了进一步研究,测得油酸的tr=7.01 min,平均TWCCSN2=178.8 Å2。观察到反油酸的tr=7.07 min,平均TWCCSN2=179.8 Å2,证实检测到反油酸。橙汁,俗称“橙汁汽水”,是使用粉碎的橙子果肉(整个橙子压扁)生产的,食品中的脂肪酸就来源与此。扩展E&L谱库中的FA内容,对于鉴定橙汁中存在的其他FA组分以及使用Cyclic离子淌度质谱对FA异构物展开研究都有重要意义。
结论
本研究生成了一个包含保留时间tr、母离子、子离子和CCS值的E&L小分子ES+和ES- UPLC-IM-MS谱库,这将有利于E&L的非靶向筛查。
通过非靶向筛查两种食品样品,对生成的数据库进行了验证。本研究鉴定了所有加标分析物,这为离子淌度增强质谱库的重现性和效用提供了信心。此外,还鉴定了普遍存在的塑料成分。
通过检测实验室硬件和耗材中存在的天然FA化合物(也是“可浸出”分析物),说明了E&L谱库组分的多样性以及有效筛查E&L的所面对的复杂挑战。在黑加仑苹果汁中鉴定出的甜味剂食品添加剂E 420(D-山梨醇)是苹果和黑加仑中存在的一种天然产物。在橙汁中鉴定出的三醋酸甘油酯(也是一种食品添加剂(E1518))可能是木松香甘油酯的一种成分。
除CCS值外,离子淌度还在另一个维度上提供特异性,来净化母离子和子离子谱图。谱库的质量,而不仅仅是大小,对于快速测量样品中的E&L至关重要。
对于这项使用UNIFI工作流程执行的研究,tr、CCS、母离子和子离子等谱库内容提供的特异性使检出的分析物能够得到快速鉴定和合理解释,说明了离子淌度质谱库在鉴定E&L方面的宝贵优势。
参考资料
- Food and Drug Administration, 2000, Code of Federal Regulation Chapter 21.
- Official Journal of the European Union, 2004, Regulation 1935/2004/EC.
- Official Journal of the European Union, 2006, Regulation 2023/2006/EC.
- Official Journal of the European Union, 2011, Regulation 10/2011/EU.
- Official Journal of the European Union, 2006, Regulation 1907/2006/EC.
- Official Journal of the European Union, 2009, Regulation 2009/49/EC.
- Official Journal of the European Union, 1987, Directive 87/357/EEC.
- Dzumana Z, Zachariasovaa M, Veprikovaa Z, Godulab M, Hajslovaa J. Multi-Analyte High Performance Liquid Chromatography Coupled to High Resolution Tandem Mass Spectrometry Method for Control of Pesticide Residues, Mycotoxins, and Pyrrolizidine Alkaloids.Anal.Chim.Acta.2015; 863:29–40.
- Pérez-Ortega P, Lara-Ortega FJ, García-Reyes JF, Gilbert-López B, Trojanowicz M, Molina-Díaz, A. A Feasibility Study of UHPLC-HRMS Accurate-Mass Screening Methods for Multiclass Testing of Organic Contaminants in Food, 2016, Talanta 160, 704–712.
- Pérez-Ortega P, Lara-Ortega FJ, Gilbert-López B, Moreno-González D, García-Reyes JF, Molina-Día A. Screening of Over 600 Pesticides, Veterinary Drugs, Food-Packaging Contaminants, Mycotoxins, and Other Chemicals in Food by Ultra-High Performance Liquid Chromatography Quadrupole Time-of-Flight Mass Spectrometry (UHPLC-Q-ToF-MS). Food Anal.Methods. 2017; 10:1216–1244.
- Romero-González R. Food safety: How Analytical Chemists Ensure It.Anal.Methods. 2015; 7:7193–7201.
- Coscollà C, León N, Pastor A, Yusà V. Combined Target and Post-run Target Strategy for a Comprehensive Analysis of Pesticides in Ambient Air Using Liquid Chromatography-Orbitrap High Resolution Mass Spectrometry.J. Chromatogr.A. 2014; 1368:132–142.
- Sjerps RMA, Vughs D, van Leerdam JA, ter Laak TL, van Wezel AP. Data-Driven Prioritization of Chemicals for Various Water Types Using Suspect Screening LC-HRMS. Water Research.2016; 93:254–264.
- Pringle SD, Giles K, Wildgoose, J. An Investigation of the Mobility Separation of Some Peptide and Protein Ions Using a New Hybrid Quadrupole/Travelling Wave IMS/oa-ToF instrument.International Journal of Mass Spectrometry.2014, 26, 1-12.
- Giles K, Pringle SD, Worthington KR, Little D, Wildgoose J, Bateman RH.Applications of a Travelling Wave-Based Radio-Frequency Only Stacked Ring Ion Guide.Rapid Commun.Mass Spectrom.2004, 18, 2401.
- McCullagh M, Pereira C.AM, Yariwake JH.Use of Ion Mobility Mass Spectrometry to Enhance Cumulative Analytical Specificity and Separation to Profile 6‐C/8‐C glycosylflavone Critical Isomer Pairs and Known–Unknowns in Medicinal Plants.Phytochemical Analysis. 2019, 30(4), 1–13.
- McCullagh M, Douce D, Van Hoeck E, Goscinny S. Exploring the Complexity of Steviol Glycosides Analysis Using Ion Mobility Mass Spectrometry.Anal.Chem.2018, 90, 4585–4595.
- McCullagh M, Pereira C.AM, Yariwake JH.Use of Ion Mobility Mass Spectrometry to Enhance Cumulative Analytical Specificity and Separation to Profile 6‐C/8‐C glycosylflavone Critical Isomer Pairs and Known–Unknowns in Medicinal Plants.Phytochemical Analysis.2019, 30(4), 1–13.
- Goscinny S, McCullagh M, Far F, De Pauw E, Eppe G. Towards the Use of Ion Mobility Mass Spectrometry Derived Collision Cross Section as a Screening Approach for Unambiguous Identification of Targeted Pesticides in Food.Rapid Commun.Mass Spectrom.2019, 33(S2), 1–15.
- Nye LC, Williams, JP, Munjoma NC, Letertre, MPM, Coen M, Bouwmeester R, Nicholson, JK, Plumb RS, McCullagh M, Gethings L, Lai S, Langridge J, Vissers JPC, Wilson ID.A Comparison of Collision Cross Section Values Obtained via Ion Mobility Spectrometry Following Direct Infusion and an Evaluation of U(H)PLC-IM-MS for the Characterisation of Metabolites in Rat Urine.J Chromatogr A 2019 Sep 27; 1602:386–396.
- McCullagh M, Goshawk J, Eatough D, Mortishire-Smith R, Pereira CAM, Yariwake JH, Vissers JPC.Profiling of the Known-Unknown Passiflora Variant Complement by Liquid Chromatography - Ion Mobility - Mass Spectrometry.Vissers.Talanta 221, 2021, 121311.
- Righetti L, Dreolin N, Celma A, McCullagh M, Barknowitz G, Sancho JV, Dall’Asta C. Travelling Wave Ion Mobility-Derived Collision Cross Section for Mycotoxins: Investigating Interlaboratory and Inter-Platform Reproducibility. J. Agric.Food Chem. 2020, 68, 39, 10937–10943.
- Goshawk J, Barknowitz G, and McCullagh M. A Workflow for Automatic MS Library Creation from Time-of-Flight Full-Spectra Data Processed in UNIFI.Waters, White Paper 720006783EN.2020 Feb.
- Yang Y, Hu C, Zhong H, Chen X, Chen R, Yam KL.Effects of Ultraviolet (UV) on Degradation of Irgafos 168 and Migration of Its Degradation Products from Polypropylene Films.J Agric Food Chem. 2016 Oct 19;64(41):7866–7873.
- Hermabessiere L, Receveur J, Himber C, Mazurais D, Huvet A, Lagarde F, Lambert C, Paul-Pont I, Dehaut A, Jezequel R, Soudant P, Duflos G. An Irgafos® 168 story: When the Ubiquity of an Additive Prevents Studying Its Leaching From Plastics.Sci Total Environ.2020 Dec 20; 749:141651.
- Jungmin L, Sorbitol, Rubus Fruit, and Misconception, Food Chemistry, Volume 166, 2015, Pages 616–622.
- Cheng YY, Yu JZ, Minimizing Contamination from Plastic Labware in the Quantification of C16 and C18 Fatty Acids in Filter Samples of Atmospheric Particulate Matter and Their Utility in Apportioning Cooking Source Contribution to Urban PM2.5. Atmosphere, October 2020 11(10):1120.
- Nordby H E, Nagy S. Fatty Acid Profiles of Orange and Tangor Juice Sac Lipids.Phytochemistry, 1971, Volume 10, Issue 3, Pages 615–619.
- Lamine M, Gargouri M, Rahali FZ and Mliki A. Authentication of Citrus Fruits Through a Comprehensive Fatty Acid Profiling and Health Lipid Indices: A Nutraceutical Perspective.Journal of Food Measurement and Characterization 2019 Vol.13 Issue 3 Pages 2211–2217.
- Khan, FA, et al. "Comparative Evaluation of Physiochemical and Gc-MS Analysis of Sour Oranges and Sweet Oranges Peels Oil." Life Science Journal 2013;10(10s), 205–209.
720007655ZH,2022年6月