
本应用纪要介绍了一种全面筛查方法的开发和验证,该方法采用UPLC-MS/MS技术检测动物肌肉组织中150多种不同类别的兽药。将多种化合物合并到一种筛查方法中,有助于提高操作效率并降低成本。使用常规液体萃取法(用草酸的乙腈溶液)对肌肉组织进行提取,然后使用分散固相萃取(dSPE)进行快速且经济有效的净化,并使用电喷雾和极性切换进行UPLC-MS/MS测定。尽管使用通用条件,UPLC系统仍可通过加快分析时间来提高样品通量,使各种不同的化合物始终获得良好峰形,确保极性化合物充分保留,并分离关键化合物对。使用补充欧盟委员会指令2002/657/EC的筛查方法指南,利用肌肉组织成功验证了该方法。在所有情况下,CCβ值在低于MRL的浓度水平确定,大多数情况下为0.1 µg/kg或1.0 µg/kg。由于符合验证标准,因此认为该方法具有良好的灵敏度、耐用性和专属性,适用于筛查兽药残留。
许多国家/地区采用集成方案进行食品安全检测,旨在通过从农场到餐桌的一系列连贯措施和适当监测来确保食品安全、动物健康、动物福利和植物健康,同时确保贸易的有效运作。大多数国家/地区都建立了法规认证体系,对允许使用的兽药和最大残留量(MRL)进行了规定。MRL是指因为使用兽药产品而产生的,法律允许或认为在食品中或食品上可接受的最大残留浓度。禁止使用未经批准的药物,禁用兽药无MRL。欧盟委员会指令2002/657/EC规定了最低要求执行限量(MRPL)1,但是仅针对有限数量的违禁物质,欧盟参考实验室设定了建议浓度(RC)值,对于未规定MRL的物质,该值旨在改善并协调分析方法的性能2。
监测兽药残留不仅是通过检查是否符合MRL及其他执行限量以支持监管架构的要求,也是行业保护客户和行业/品牌的要求。欧洲的不合格率非常低(只有0.3%的样品检测结果为“阳性”)3,因为需要实施两阶段方法。首先使用筛查方法检测某种或某类物质是否以目标含量存在。使用微生物生长抑制等方法,可以经济有效地筛查大量样品中是否具有潜在的不合格结果。如果在特定范围(无论是在分析物覆盖范围还是样品类型方面)以外使用,此类检测试剂盒通常会产生假阳性结果。筛查检测的任何“疑似阳性”结果都会触发第二阶段:即重复分析以确认结果。必须重新分析样品以定量测定残留,且鉴定结果符合可接受标准。
LC-MS/MS可以将方法的适用范围扩展至许多不同类别的分析物,适用于多种基质。这种筛查方法由于具有良好的专属性、灵敏度和较低的假阳性样品率而越来越常用。大多数筛查工作流程都着眼于靶向方法,以预定的截止水平寻找已知物质,从而评估样品中是否包含高于筛查目标浓度(STC)的兽药残留。STC是指证明化合物可以在至少95%的样品中检出的最低浓度(假合格结果少于5%)4。STC低于法规/执行限量越多,在包含该限量药物的样品中获得假合格结果的概率就会越低。如果出于此目的进行验证,随后可以使用相同的方法进行确认(重复分析),但需要满足相关的分析质量控制可接受标准。
本应用纪要介绍了一种多残留方法的验证,该方法使用ACQUITY UPLC I-Class PLUS与Xevo TQ-XS联用系统测定不同物种肌肉组织中13种不同类别的兽药残留。
各种动物的肌肉组织碎片样品购自当地超市。
使用常规液体萃取法(用草酸的乙腈溶液)对肌肉组织进行提取,然后通过分散固相萃取(dSPE)进行净化(更多信息参见图1)。由于担心某些分析物的稳定性,因此将提取物储存于-20 °C下,并在萃取后2天内进行LC-MS/MS分析。
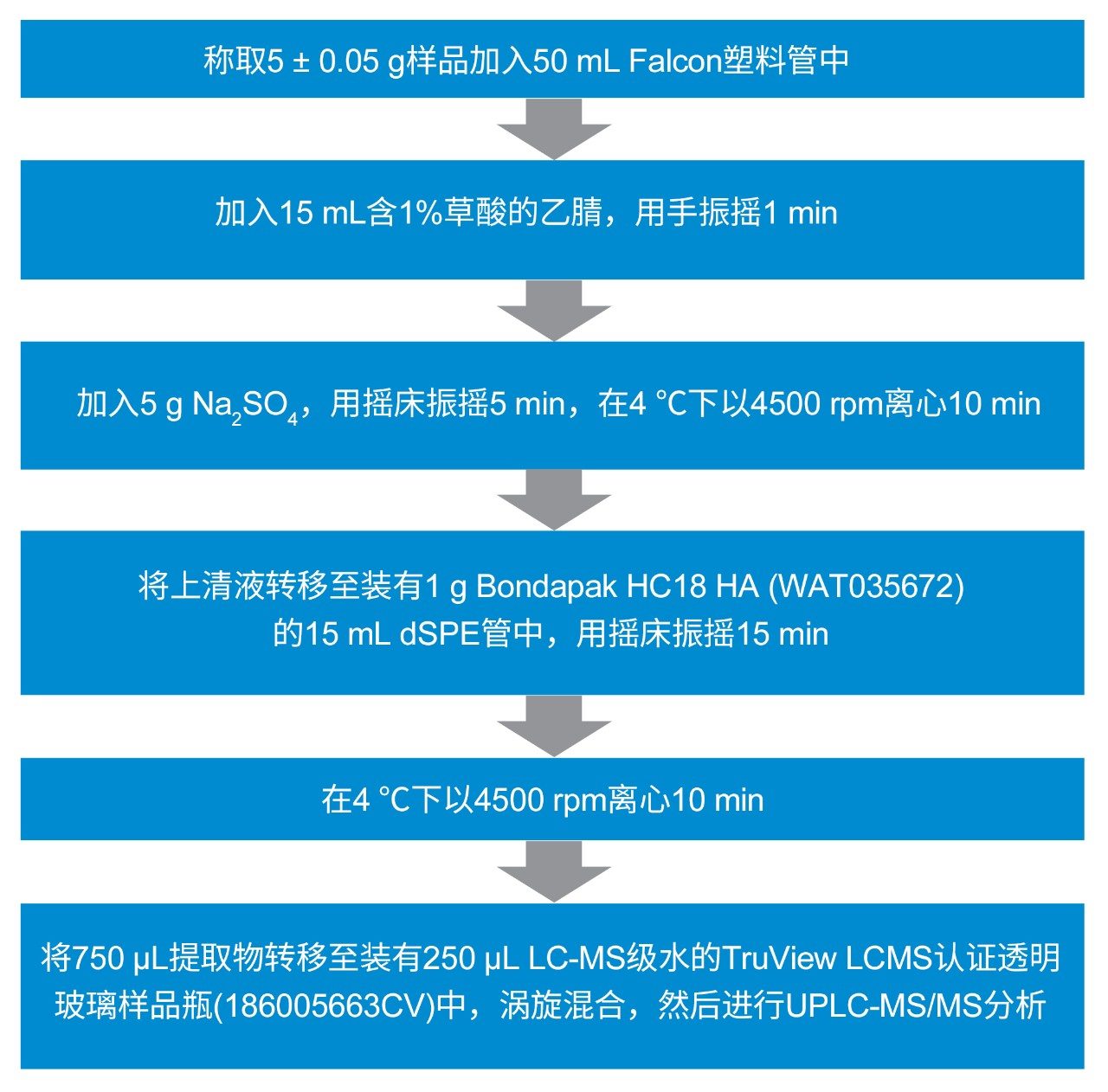
用牛肌肉组织提取物(之前显示为空白)制备基质匹配标准品,浓度为0.05~20.0 µg/kg。
|
液相色谱条件 |
|
|---|---|
|
液相色谱系统: |
配备FL样品管理器的ACQUITY UPLC I-Class PLUS |
|
色谱柱: |
HSS T3, 1.8 µm, 2.1 × 100 mm (186003539),配备ACQUITY色谱柱在线过滤器(205000343) |
|
柱温: |
40 °C |
|
样品温度: |
10 °C |
|
进样体积: |
1 μL(满环) |
|
强清洗溶剂: |
0.1%甲酸的乙腈/甲醇(1:1, v/v)溶液 |
|
弱清洗溶剂: |
含0.1 mM甲酸铵的0.1%甲酸水溶液 |
|
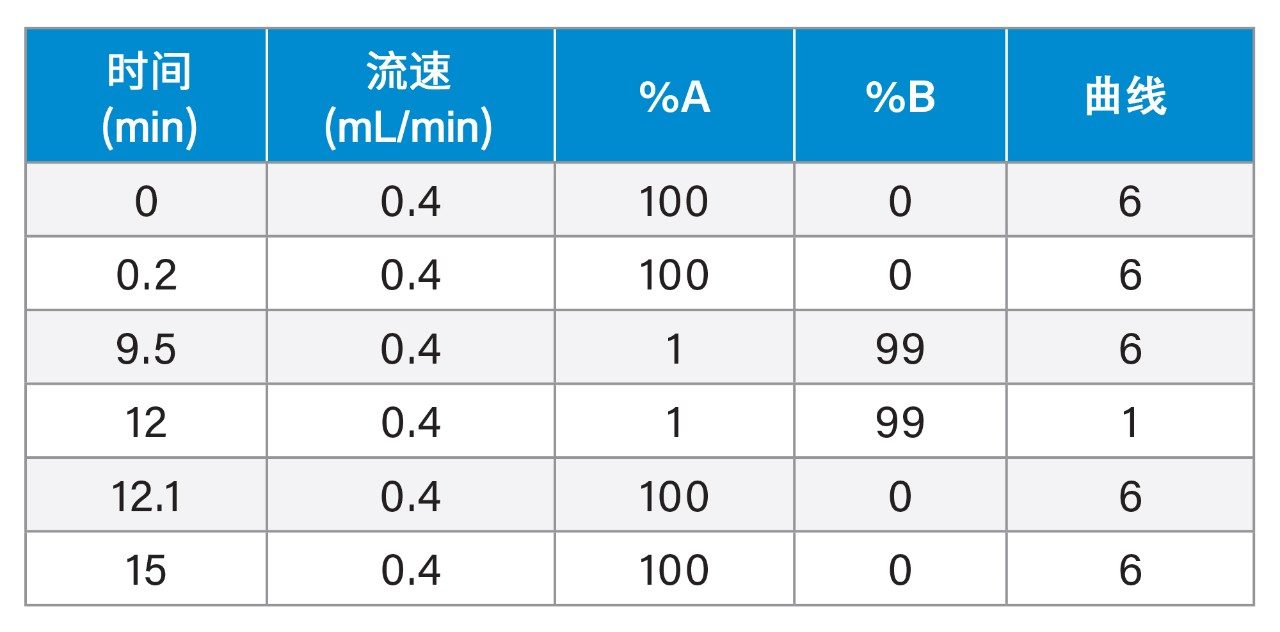
流动相A: |
含0.1 mM甲酸铵的0.1%甲酸水溶液 |
|
流动相B: |
0.1%甲酸的乙腈/甲醇(1:1, v/v)溶液 |
|
质谱系统: |
Xevo TQ-XS |
|
电离模式: |
电喷雾,使用极性切换 |
|
毛细管电压(kV): |
ESI+ 1.0,ESI- 2.5 |
|
离子源温度(°C): |
150 |
|
脱溶剂气温度(℃): |
600 |
|
脱溶剂气流速(L/h): |
1000 |
|
锥孔气流速(L/h): |
150 |
|
质谱软件: |
MassLynx 4.2版 |
|
信息学软件: |
TargetLynx XS应用软件 |
对每种化合物采集多个MRM通道。利用Autodwell功能自动设置驻留时间,使每个峰至少包含10个数据点。可以从Waters Marketplace的Quanpedia MassLynx部分下载本应用中所用的通道。
指南文件4补充了欧盟委员会指令2002/657/EC中有关筛查方法的验证以评估方法性能,本研究利用该文件中的方案评估方法性能。该验证方案的原理是评估未加标样品与加标样品的分析响应范围,并设定截止水平以确保加标样品的最低响应不被未加标样品的最高响应覆盖。截止水平是来自筛查检测的响应,其表明样品中包含的分析物处于STC或更高的水平。筛查方法不必满足欧盟委员会指令2002/657/EC中有关重复性、重现性或正确度的要求。通过分析21个空白肌肉样品(牛、猪和家禽)以及重复进样以三种不同浓度(0.1 µg/kg、1.0 µg/kg和10 µg/kg)加标的相同样品进行验证以确定STC。对于具有复合MRL定义的药物,尝试将母体化合物和/或代谢物作为残留标志物,但不尝试将任何化学转化步骤作为单个残留标志物(例如水解或氧化)纳入,因为这样对其他化合物的性能具有不利影响。
合并此前针对特定类别或化合物的方法中涵盖的许多化合物,有助于提高操作效率并降低成本。因此,该方法必须应对许多具有不同化学性质的化合物,依赖通用萃取条件和有限的净化操作以确保获得足够高的分析物回收率。某些类别(例如氨基糖苷类)化合物的极性过强,无法纳入该多残留方法的范围内,而是依赖于单独针对特定类别的方法5。
乙腈与水的混合溶液可以从基质中提取各种分析物,因为它能够使极性分析物和非极性化合物均获得足够高的萃取效率。四环素与样品中的多价阳离子和蛋白质发生螯合,导致萃取效率较低。向萃取溶剂中加入1%草酸,可大幅减少食品基质中金属离子与分析物的螯合,有助于提高四环素的回收率。由于分析物的化学性质范围很广,因此必须采用通用性强、非选择性的净化方法。目的是去除一些影响分析性能的共提取物,而不会导致分析物明显损失。磷脂、其他脂质和色素可能引起基质效应(通常是由于离子抑制)并污染色谱柱和LC-MS/MS硬件,导致色谱柱更换和系统维护的频率增加。如果不进行检查,这些问题通常会导致系统性能迅速发生显著下降,引起批处理失败,使用户对LC-MS/MS系统的稳定性失去信心。本研究利用一种简单且经济有效的dSPE净化方法去除了许多共提取物(包括监测的40%磷脂),同时避免分析物大量损失。
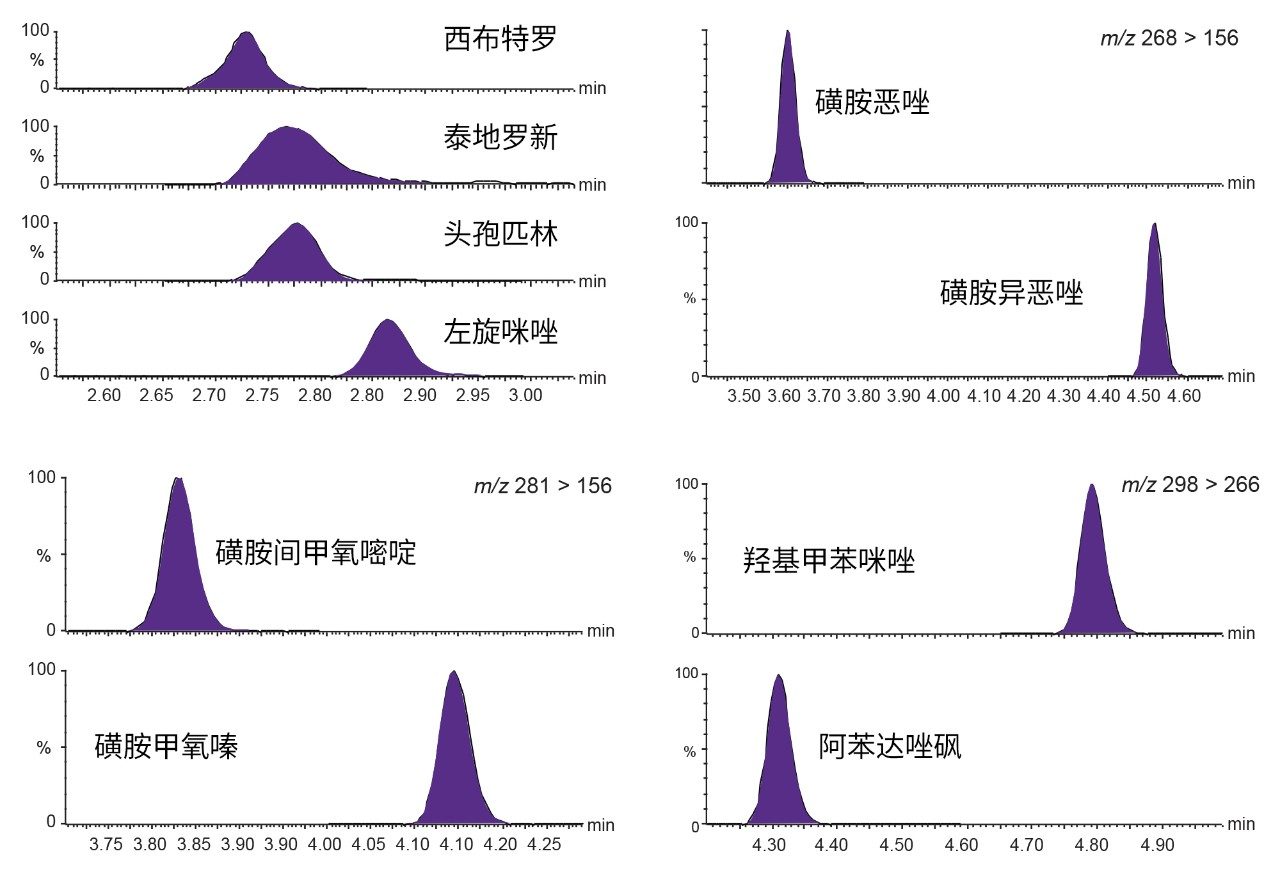
HSS T3色谱柱为所有分析物提供了优异的保留性能和峰形,还能够分离同量异位化合物(图2)。所有峰均在1.65~11 min之间洗脱,总运行时间为15 min。
检测容量(CCβ)是物质在样品中以5%的假阴性率检出的最低含量。对于许可的药物活性物质,CCβ应小于MRL;但是对于违禁或未经许可的物质,CCβ则应低至分析可达到的最低水平。通过比较阈值(T)和截止因子(Fm)来评估CCβ。
阈值(T)是对应于最低分析响应的值,高于该响应的样品才能被视为阳性。通过分析不同来源的21个空白样品来确定该参数,并使用以下公式进行计算:
T = B + (1.64 × SDb),
其中考虑到空白响应/噪音的平均值“B”以及空白响应/噪音的标准偏差“SDb”。因子1.64是在显著性水平β = 0.05上自由度无穷大的单尾学生t检验值。截止因子(Fm)通过分析以各种目标含量的分析物加标的21个空白样品确定。确定每种分析物的响应,并使用以下公式计算Fm:
Fm = M - (1.64 × SD),
其中考虑到每种分析物的平均响应“M”和标准偏差“SD”。
根据欧盟委员会指令2002/657/EC,当Fm > B时,CCβ有效。当Fm > T时,假阳性率可接受(即5%)。因此,当B < T < Fm时,CCβ才真正低于加标浓度,测试的STC表明假阴性率 = 5%,假阳性率< 5%。当T > Fm时,超过5%的加标样品将被视为阴性,因此无法确定该加标浓度下的CCβ,需要在更高浓度下重复评估。
图3展示了混合肌肉样品中禁用物质氨苯砜的空白响应(B)、阈值(T)和截止因子(Fm)。当加标浓度为0.1 µg/kg时,B < T < Fm,因此可以将STC确定为0.1 µg/kg,其远低于肌肉中的RC (5 µg/kg)。
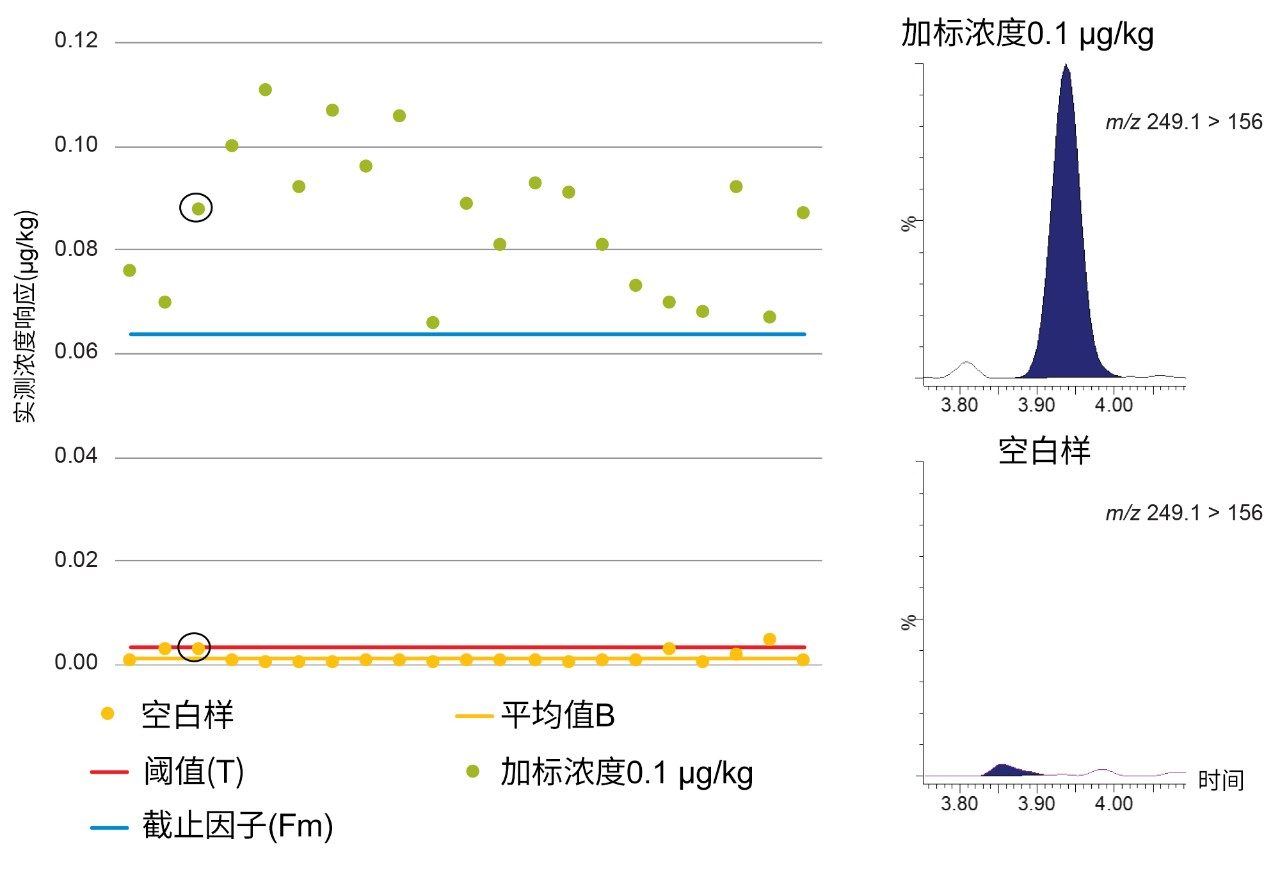
图4展示了混合肌肉样品中阿苯达唑亚砜的空白响应(B)、阈值(T)和截止因子(Fm)。当加标浓度为0.1 µg/kg时,B < T < Fm,因此可以将STC确定为0.1 µg/kg,其远低于牛肌肉中的MRL 100 µg/kg(阿苯达唑SOX、阿苯达唑SON与阿苯达唑2-氨基砜的总含量)。
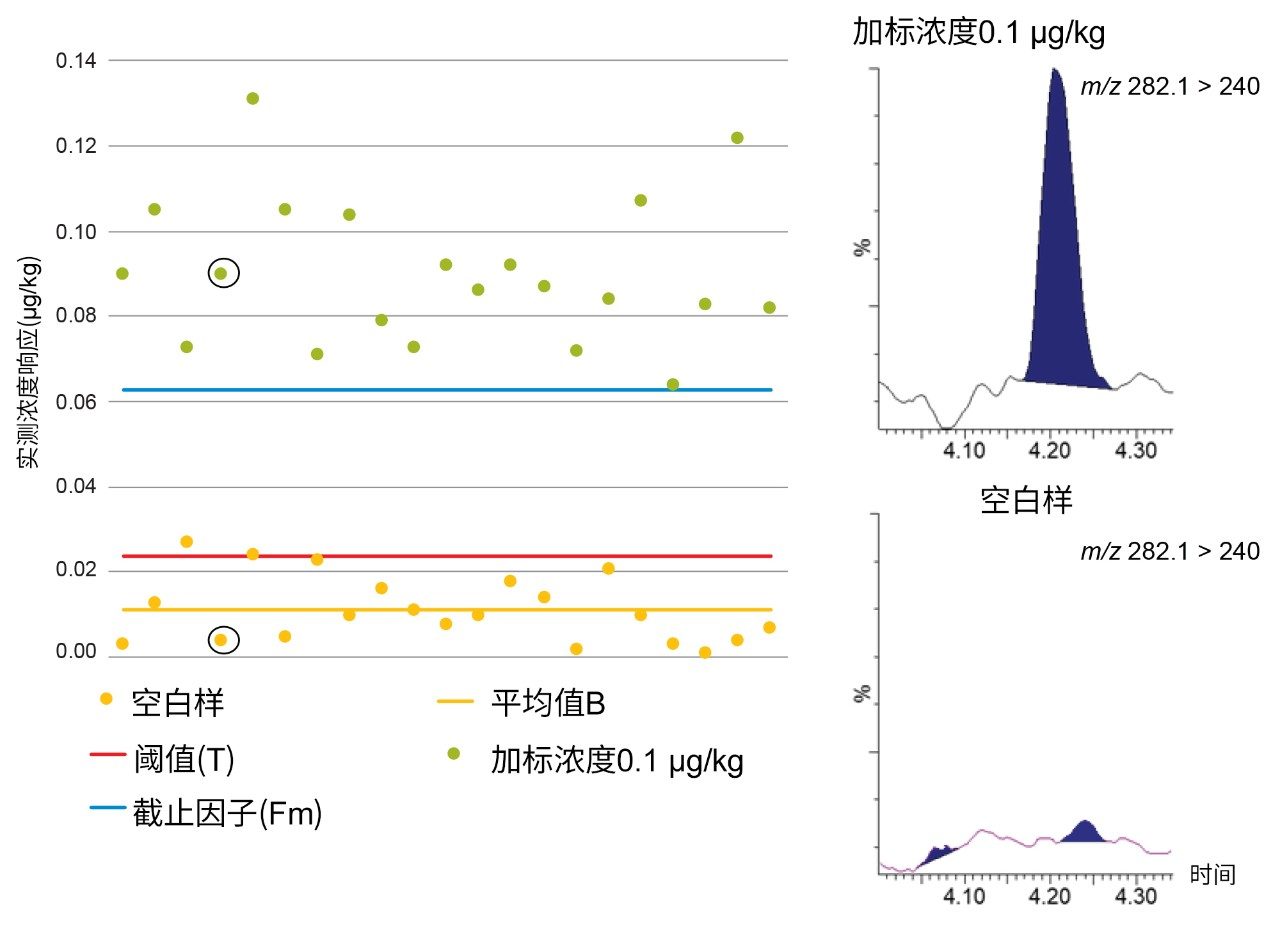
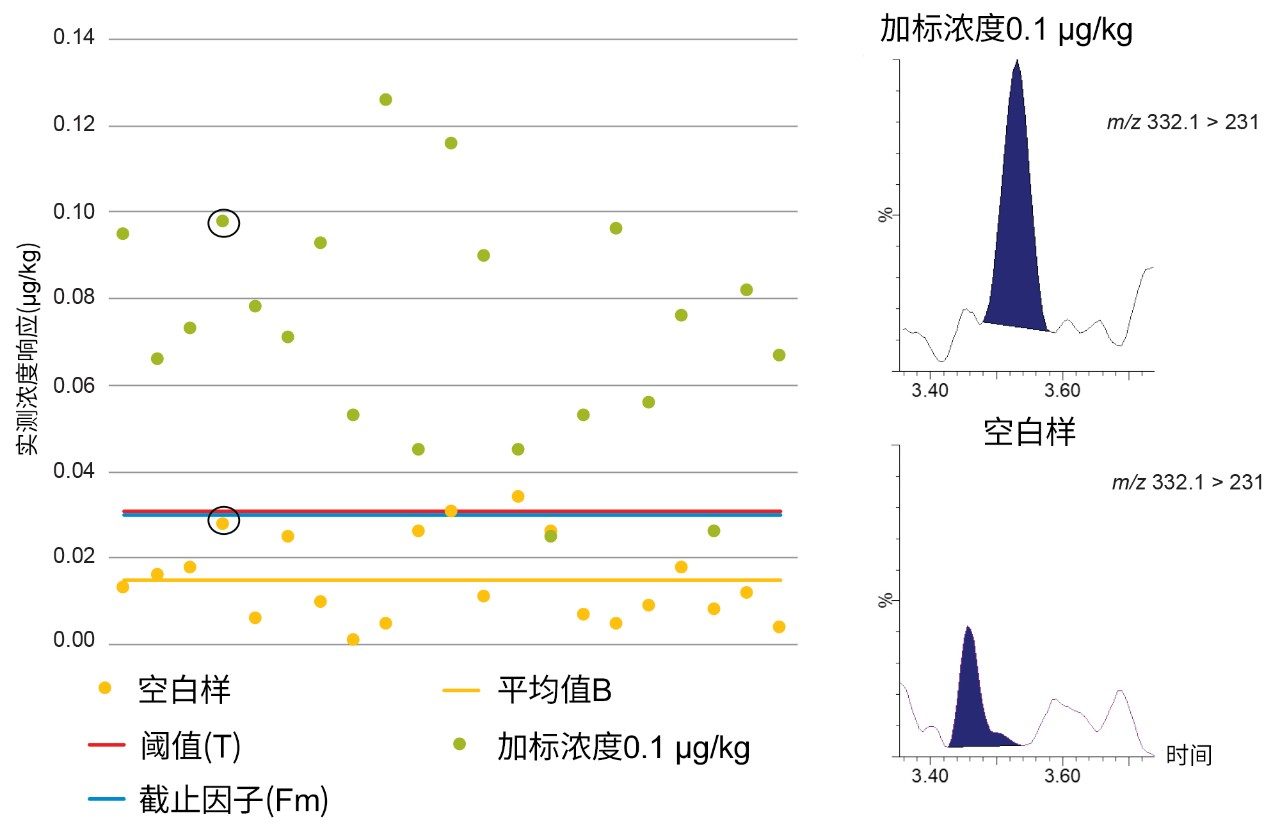
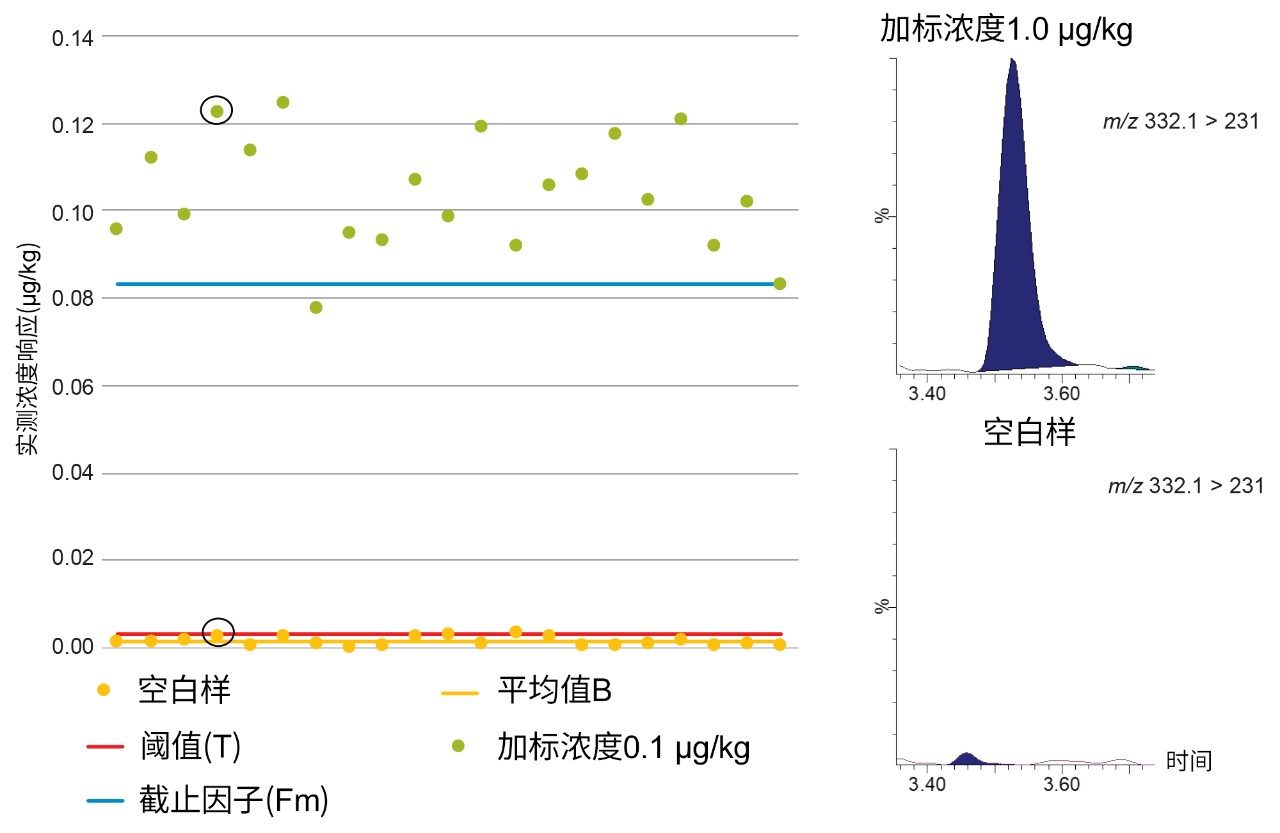
在第三个示例中,图5展示了混合肌肉样品中环丙沙星的空白响应(B)、阈值(T)和截止因子(Fm)。当加标浓度为0.1 µg/kg时,T > Fm,因此不能将STC确定为0.1 µg/kg。相比之下,图6表明,当加标浓度为1.0 µg/kg时,B < T < Fm,因此将CCβ确定为≤1.0µg/kg,其远低于牛肌肉中的MRL 100 µg/kg(恩诺沙星与环丙沙星的总含量)。
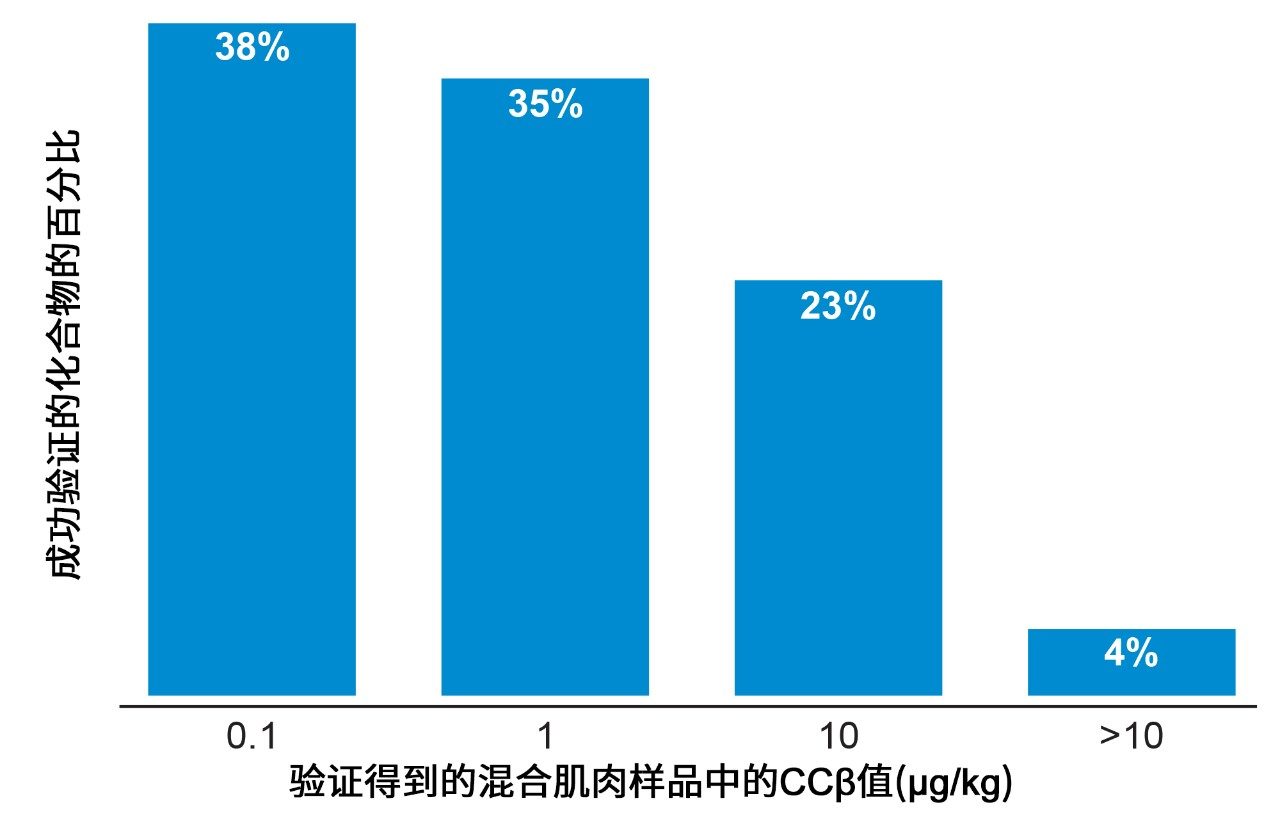
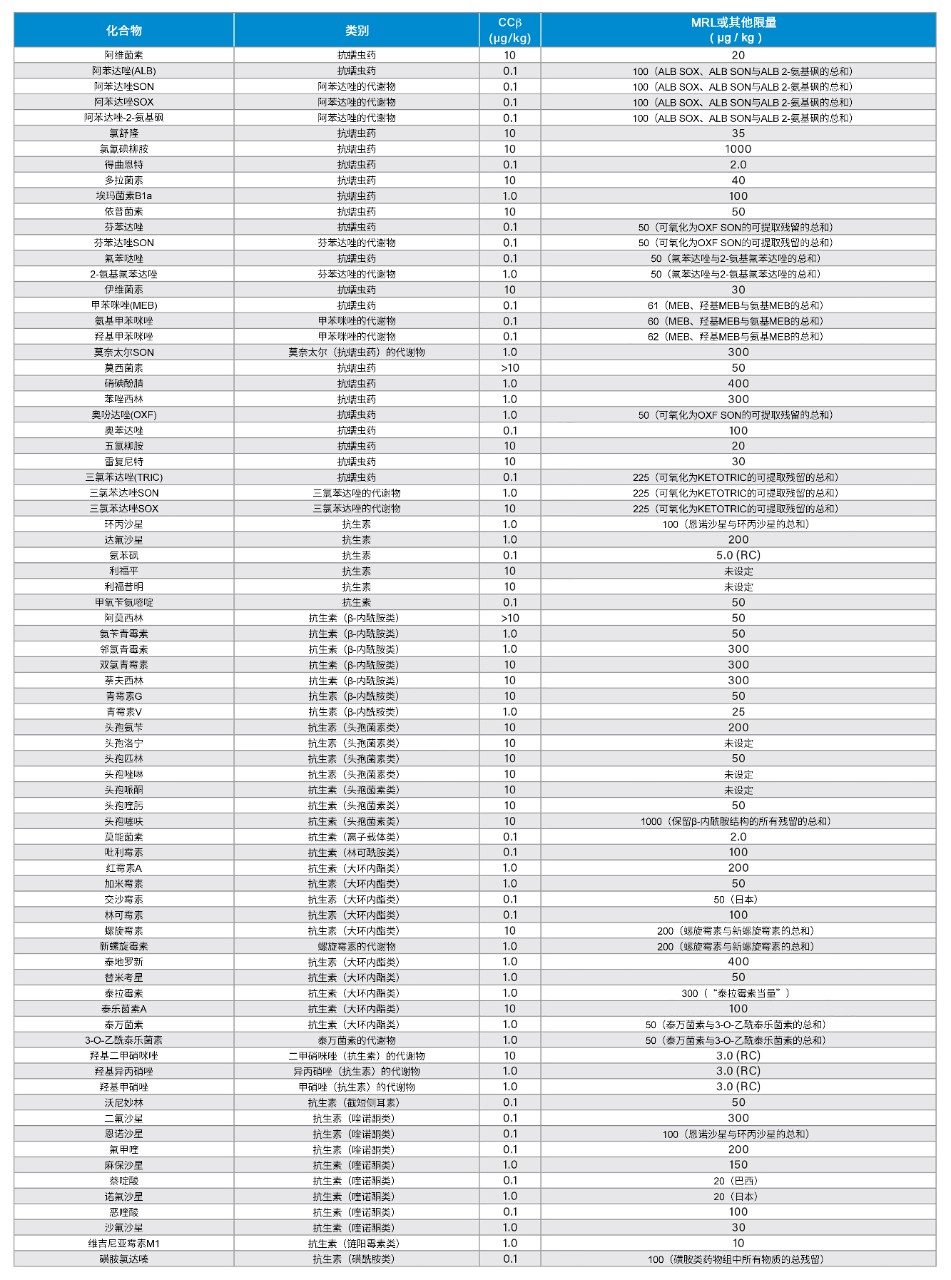
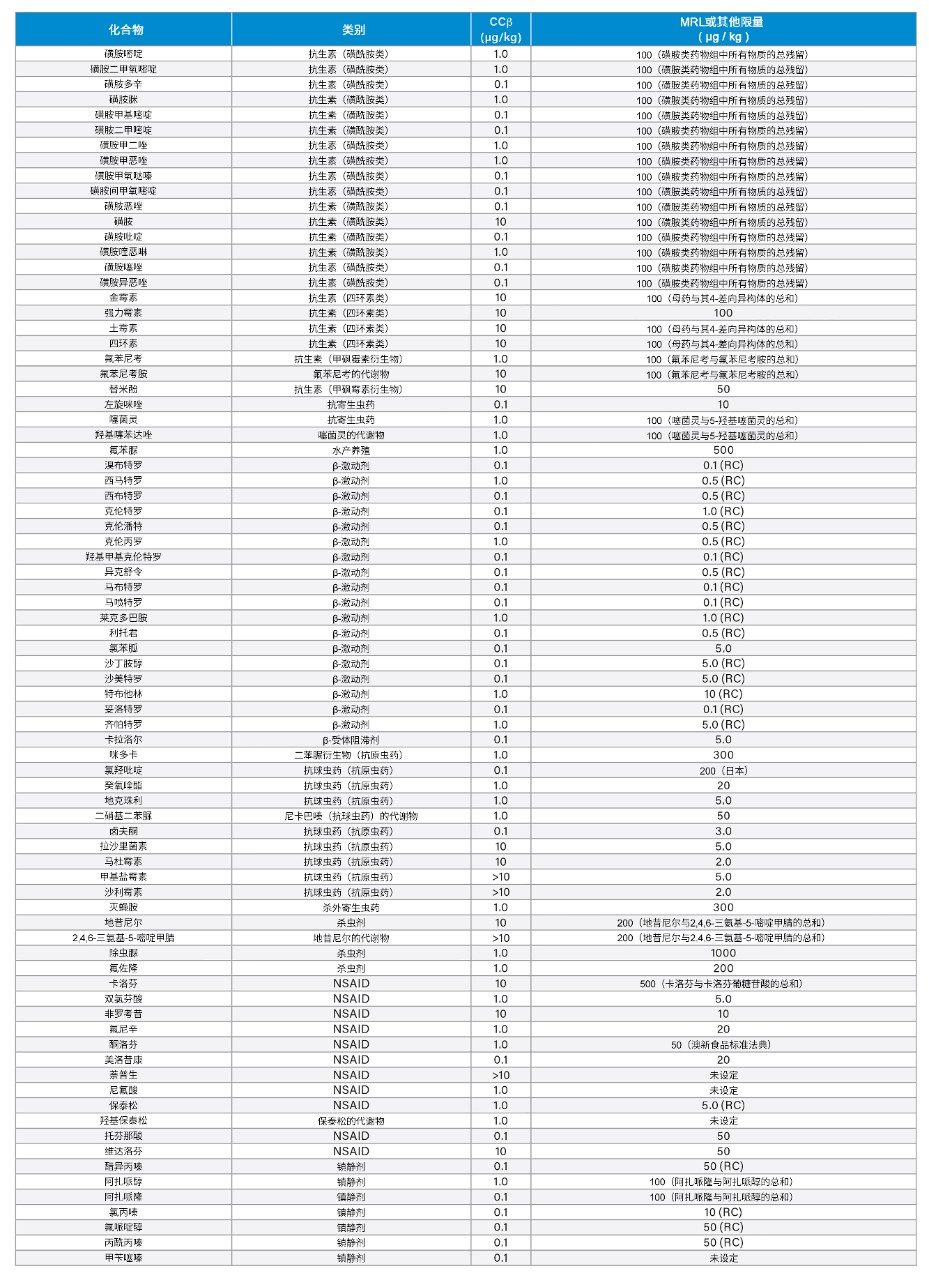
总体而言,本研究可以展示在动物肌肉组织中筛查158种被测分析物所得其中152种的验证数据,近70%的化合物的CCβ确定为0.1 µg/kg或1.0 µg/kg(图7)。附表展示了各分析物的CCβ值及相关MRL的汇总。MRL因不同基质和物种而异,因此选择最低动物组织MRL进行比较。对于确定了MRL的化合物,CCβ值应小于或等于MRL。对于尚未确定法规限值的分析物,CCβ必须尽可能低或低于任何MRPL或RC值。
LC-MS/MS已成为一种强大的筛查技术,可筛查动物组织及相关食品中的兽药残留。本文介绍了一种可用于分析动物组织及相关食品的多残留方法。该方法将快速提取和净化与UPLC和MS/MS的灵敏度和选择性相结合,并且成功通过验证,适用于筛查动物肌肉组织样品中浓度通常远低于MRL的各种兽药残留。在大多数情况下,CCβ值确定为0.1 µg/kg或1.0 µg/kg。由于符合验证标准,因此认为该方法具有良好的灵敏度、耐用性和专属性,适用于筛查兽药残留。
科学家必须在其实验室中对该方法进行验证,证明方法性能适合其用途,并且满足相关分析控制保证体系的要求。
720007116ZH,2021年1月