
在全球经济局势中,获得和保持竞争优势常常面临挑战。因此需要采用新仪器来提供性能和易用性方面的改进。在集成新仪器的过程中,协调多个地点的方法并控制从一个实验室到另一个实验室的方法及其他变量很重要。为应对这些挑战,建议使用基于风险的方法和控制策略。本应用纪要介绍了在八个参与地点实施USP杂质方法的全球实验室间方法转换研究。在发送实验室进行初步测试,为控制策略和转换过程提供关键信息。借助这一过程,证明系统和方法可以常规地满足系统适应性要求。
在全球经济局势中,获得和保持竞争优势常常面临挑战。因此需要采用新仪器来提供性能和易用性方面的改进。在评估新仪器时(特别是对于方法转换),控制并了解系统配置非常重要。此外,需要控制特定的方法条件及其他变量,尽可能减小不同实验室之间的差异。为应对这些挑战,需要充分了解可能影响方法性能和控制策略的风险,尽可能降低这些风险。
本应用纪要介绍了在全世界八个地点实施的USP有机杂质分析方法的全球实验室间转换。在Arc HPLC系统上进行转换。开展研究之前,发送实验室实施了稳定性和验证测试。该过程涉及多方面,包括在发送实验室进行风险评估。控制策略提供了从发送实验室到接收实验室的标准操作程序(SOP)和关键材料。借助这些控制策略,可以控制系统和方法变量以实现成功的方法转换。
该方法基于USP富马酸喹硫平杂质专论1,未作任何调整。
该方法使用系统适应性参比标准品(RS)和富马酸喹硫平RS。系统适应性溶液由USP喹硫平系统适应性RS(USP部件号1592715)制得,包含喹硫平、脱乙氧基喹硫平(1–5%)、相关化合物G和相关化合物B标准品的混合物。使用稀释剂(86:14溶液A/溶液B),由喹硫平系统适应性RS制备浓度为1 mg/mL的系统适应性溶液。利用USP富马酸喹硫平RS在稀释剂中制得浓度为0.001 mg/mL的标准溶液。
原料药购自杭州思诺科生物医药有限公司,已过期。用溶液A制备浓度为1.0 mg/mL的样品。
|
色谱柱: |
XBridge C8 3.5 µm, 4.6 × 150 mm(沃特世部件号:186003055) |
|
柱温: |
45 °C |
|
样品温度: |
10 °C |
|
进样体积: |
20 µL |
|
检测条件: |
250 nm |
|
数据采集速率: |
10 Hz |
|
流速: |
1.5 mL/min |
|
运行时间: |
70 min |
|
缓冲液: |
3.1 g/L醋酸铵水溶液。向每升溶液中加入2 mL 25%氢氧化铵,pH = NLT 9.2 |
|
溶液A: |
乙腈:缓冲液(25:75) |
|
溶液B: |
乙腈 |
|
洗针液: |
水:乙腈(50:50) |
|
清除溶剂: |
水:乙腈(50:50) |
|
密封件清洗液: |
水:乙腈(90:10) |
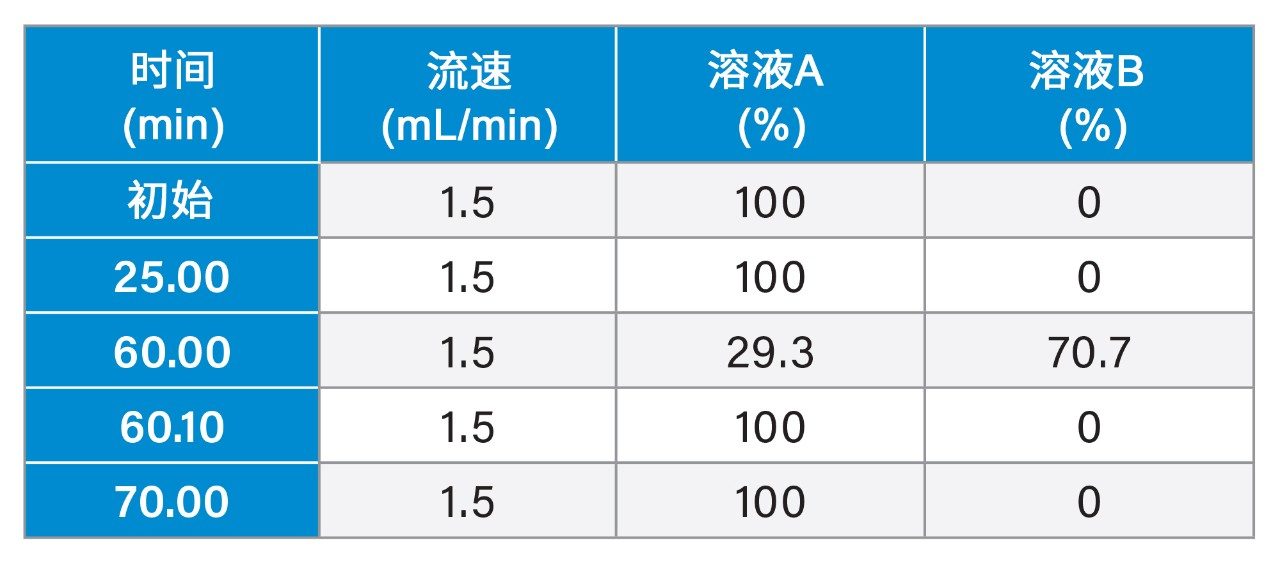
|
Empower 3色谱数据软件 |
|
系统: |
Arc HPLC系统(配备QSM-R、FTN-R和CHC) |
|
检测条件: |
2998 (PDA)或2489 (TUV) |
|
配置: |
被动预加热器(首选) |
|
流通池: |
分析型 |
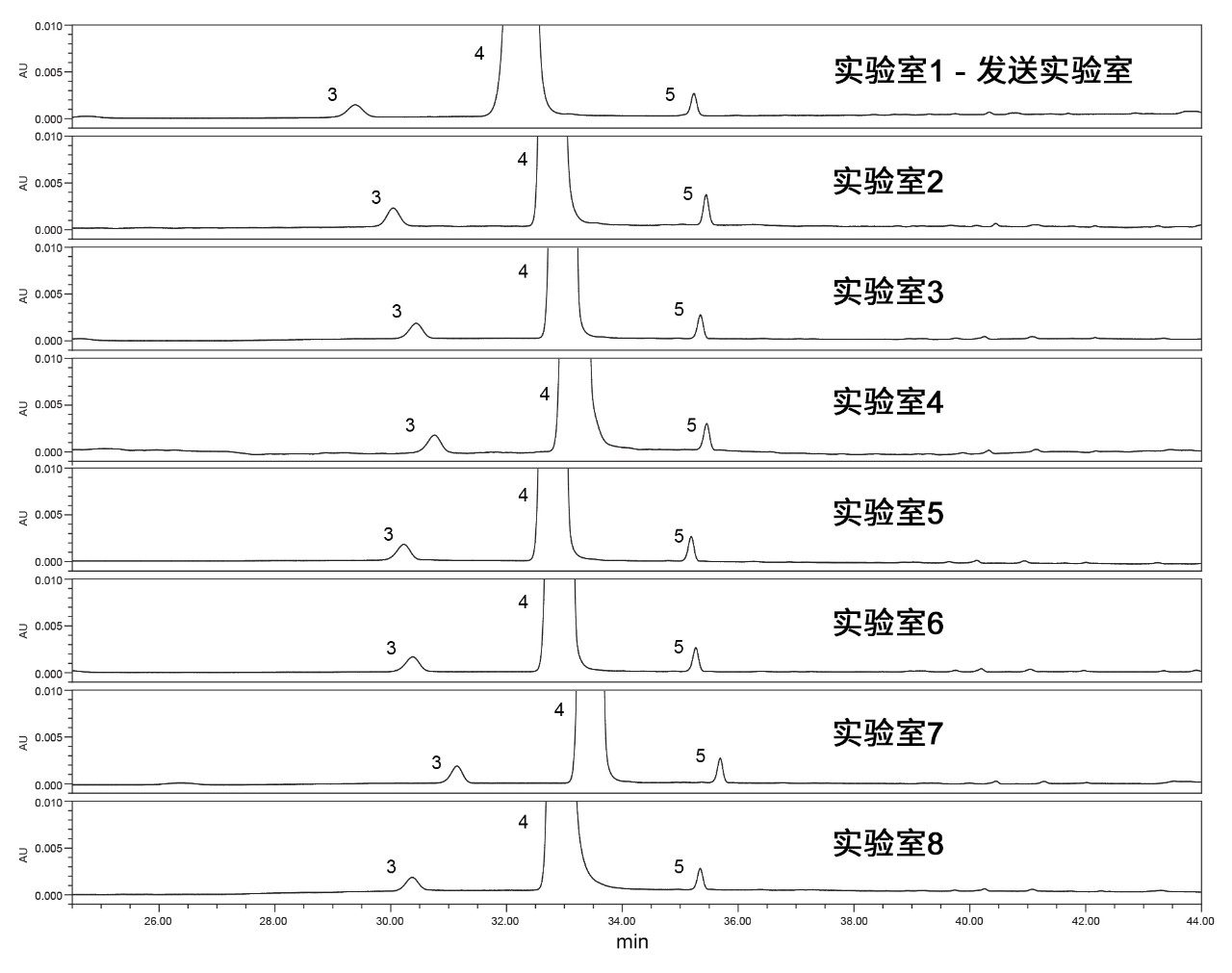
在世界各地实施USP富马酸喹硫平杂质分析1的方法转换。发送实验室位于美国马萨诸塞州米尔福德,七个接收实验室则分别位于马萨诸塞州米尔福德(第二实验室)、土耳其、印度、新加坡、中国、法国和美国北卡罗来纳州。本研究包括验证系统适应性要求和定量分析原料药。所有分析均采用配备可变波长(TUV) 2489检测器或光电二极管阵列(PDA) 2998 检测器的Arc HPLC系统。每次分析均根据专论中所述的系统适应性要求进行评估,分析原料药并比较杂质分析结果。系统适应性标准基于系统适应性溶液中两对关键化合物的分离度以及标准溶液的拖尾、保留时间%RSD和峰面积%RSD。
为确保方法性能不受众多变量的影响,本研究采用基于风险的方法。该方法包括多个步骤:
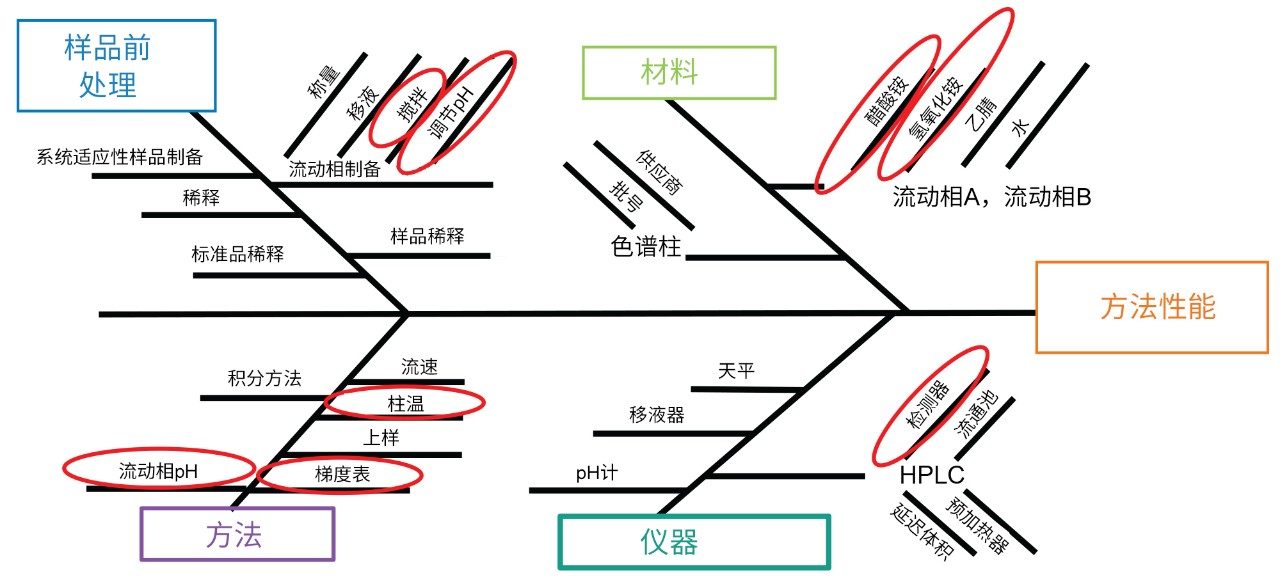
首先通过查看方法并收集熟悉该方法的主题专家和科学家的意见来进行风险评估。利用鱼骨图或石川图(图1)确认可能影响方法性能(包括满足系统适应性和定量测量要求)的潜在变量。方法差异的潜在原因分为四类,包括样品前处理、材料、方法参数和仪器。对于每个类别,将具体特性确定为可能影响方法性能的风险。基于收集到的知识,确定那些将产生最大变异性的变量(红色圆圈)。例如,将柱温确定为一个关键变量,因为该方法需要45 °C的高温。材料(包括乙酸铵和氢氧化铵)的浓度可能随时间的推移而改变,从而导致保留时间差异。确定的其他变量包括流动相的搅拌和pH调节、流动相pH值以及检测器。
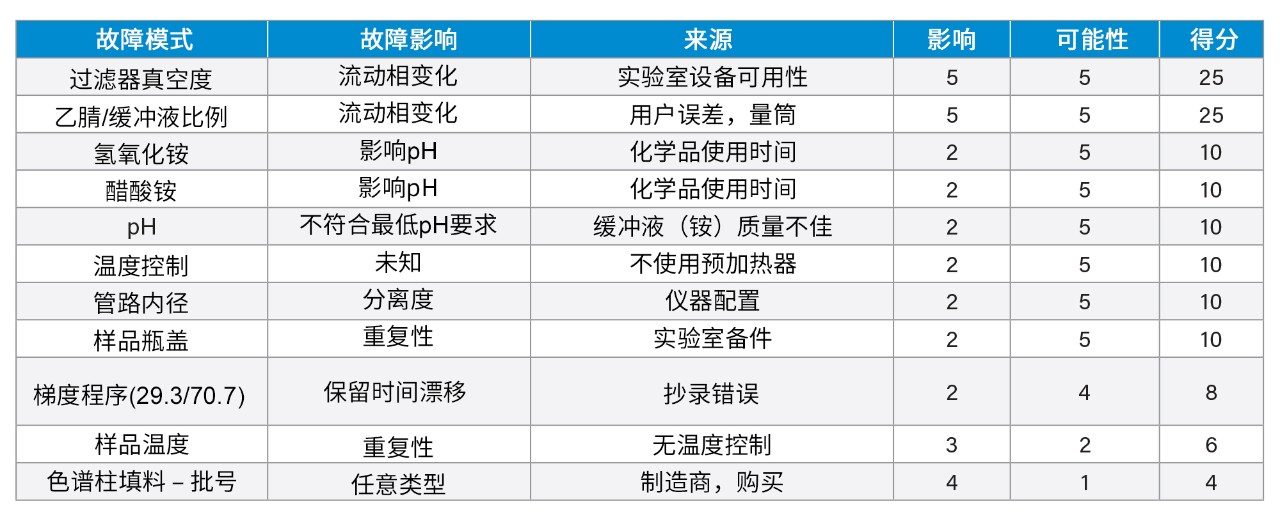
确定引起差异的关键原因后,科学家将根据变量对方法性能的影响对其进行排序或评分。通过确定故障模式(基于上述输入)及其对方法性能的影响,进行进一步的风险评估。按影响和可能性对各种故障模式进行评分。根据之前的研究,将关键故障模式确定为溶剂A的缓冲液/乙腈比例和缓冲溶液的pH调节。此前的稳定性研究已经确定,缓冲液/乙腈比例会影响选择性和分离度。基于这些信息,过滤器真空度和缓冲液/乙腈比例具有很大影响。过滤时真空度过高,可能导致有机物蒸发,从而影响缓冲液/有机相比例。这些故障模式中的每一种都可能发生,因为在该方法中进行了过滤,并且按体积混合两种溶剂通常会受到量筒类别的影响。其他高风险因素包括缓冲液pH值和温度控制。
为减少方法转换研究的差异性,根据风险评估的结果制定了控制策略,包括由发送实验室为接收实验室提供关键材料和SOP。将一个化学试剂盒寄送至所有接收实验室,其中包括标准品、色谱柱和原料药。标准品一次性购自供应商(USP),且原料药为同一批。但色谱柱包括两个不同的批次。由发送实验室编写SOP,然后将其发送至位于马萨诸塞州米尔福德的第二个实验室进行审查、评论和最终批准。为确保每个实验室都能够重现其不熟悉的方法,编写了详细的SOP。为确保说明全面、清晰,以米尔福德的第二个实验室作为测试实验室,对SOP进行审查并提出意见。在SOP中,还包含具体说明以控制实验室之间的差异性。例如,需要使用预加热器以减少实验室间温度差异的影响。
最后,每个实验室均使用SOP中提供的处理方法处理系统适应性分析。不过,本研究提供的所有数据都是在发送实验室处理得到的,以减少由于处理方法参数不同而导致的结果差异。
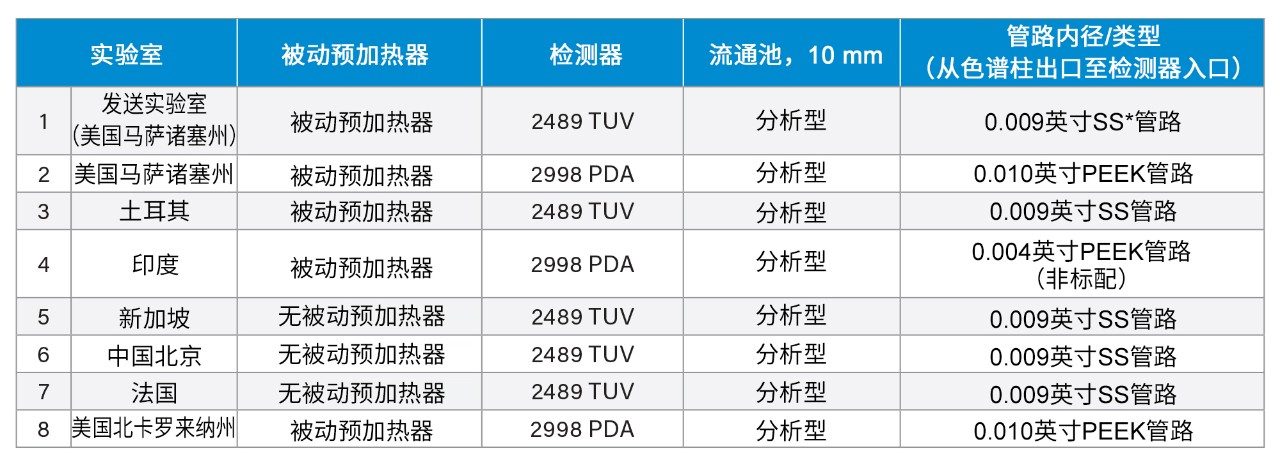
此外还发现系统配置会影响方法性能。为控制每个地点的系统配置,在提供的SOP中规定了具体配置。但是,由于部件供应上的问题,一些实验室缺少所需的配置。因此,接收实验室记录了配置差异。系统配置的重要方面包括是否使用被动预加热器、检测器(TUV或PDA)、流通池类型、流通池光程以及从色谱柱出口到检测器入口的管路内经。表2列出了每个实验室的系统配置。
如上所述,富马酸喹硫平的杂质分析方法包括两个步骤:执行系统适应性分析和原料药定量分析。原料药分析在满足系统适应性要求后进行。在多个实验室比较了每种标准品/样品。
基于这些信息,根据以下标准衡量方法转换:
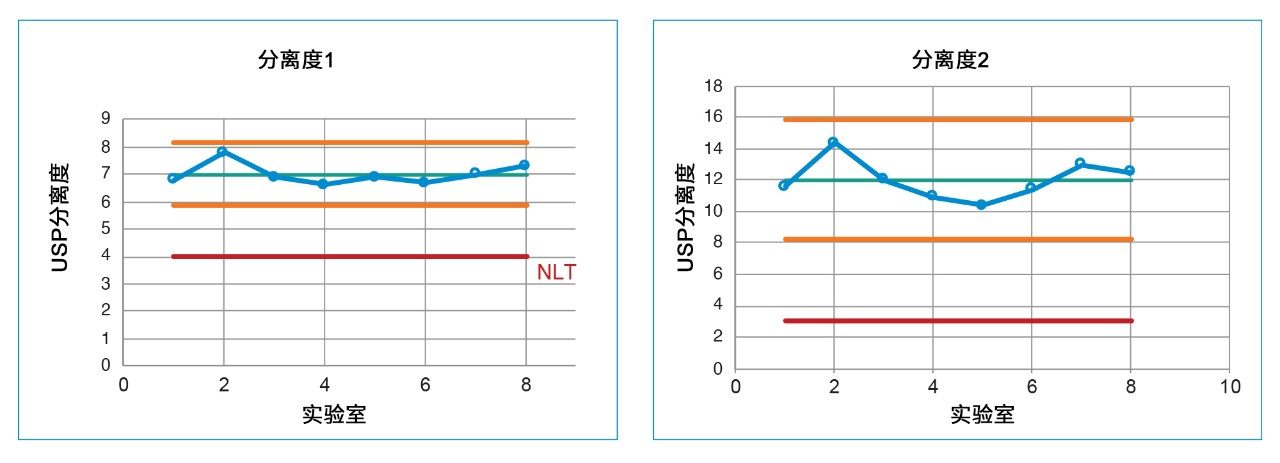
利用系统适应性溶液评估USP方法中定义的两对关键化合物的分离度。第一对关键化合物是脱乙氧基喹硫平和喹硫平(API),第二对关键化合物是相关化合物G和相关化合物B。所有实验室的结果均可参见图2。如图所示,所有实验室分析系统适应性溶液所得到的分离度1和分离度2均符合USP分离度标准。为确保研究处于受控状态,利用控制图分析了获得的分离度值。控制图(图3)显示,所有值均处于平均值的3倍标准偏差范围内,且±3倍标准偏差也处于方法的系统适应性要求范围内。
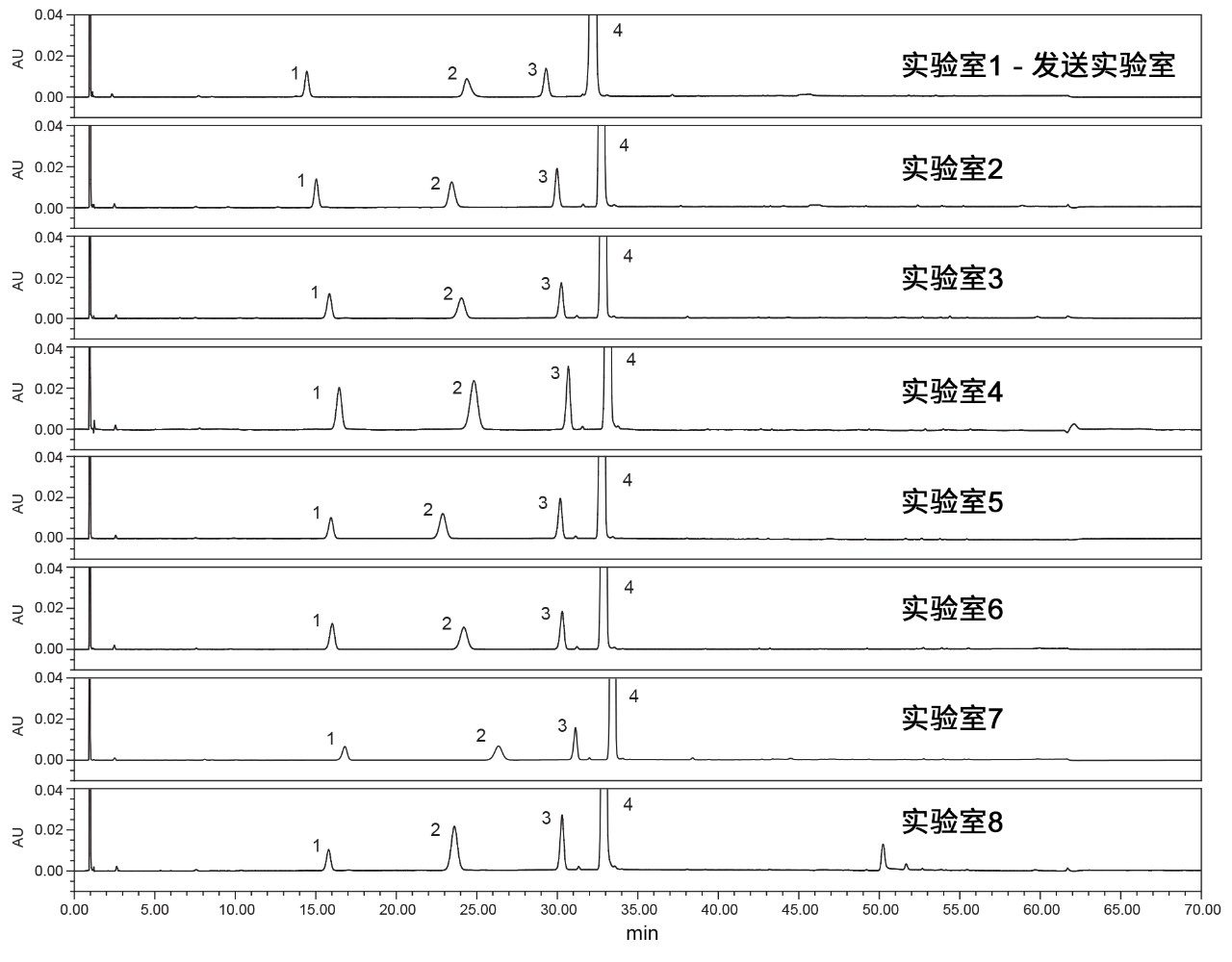
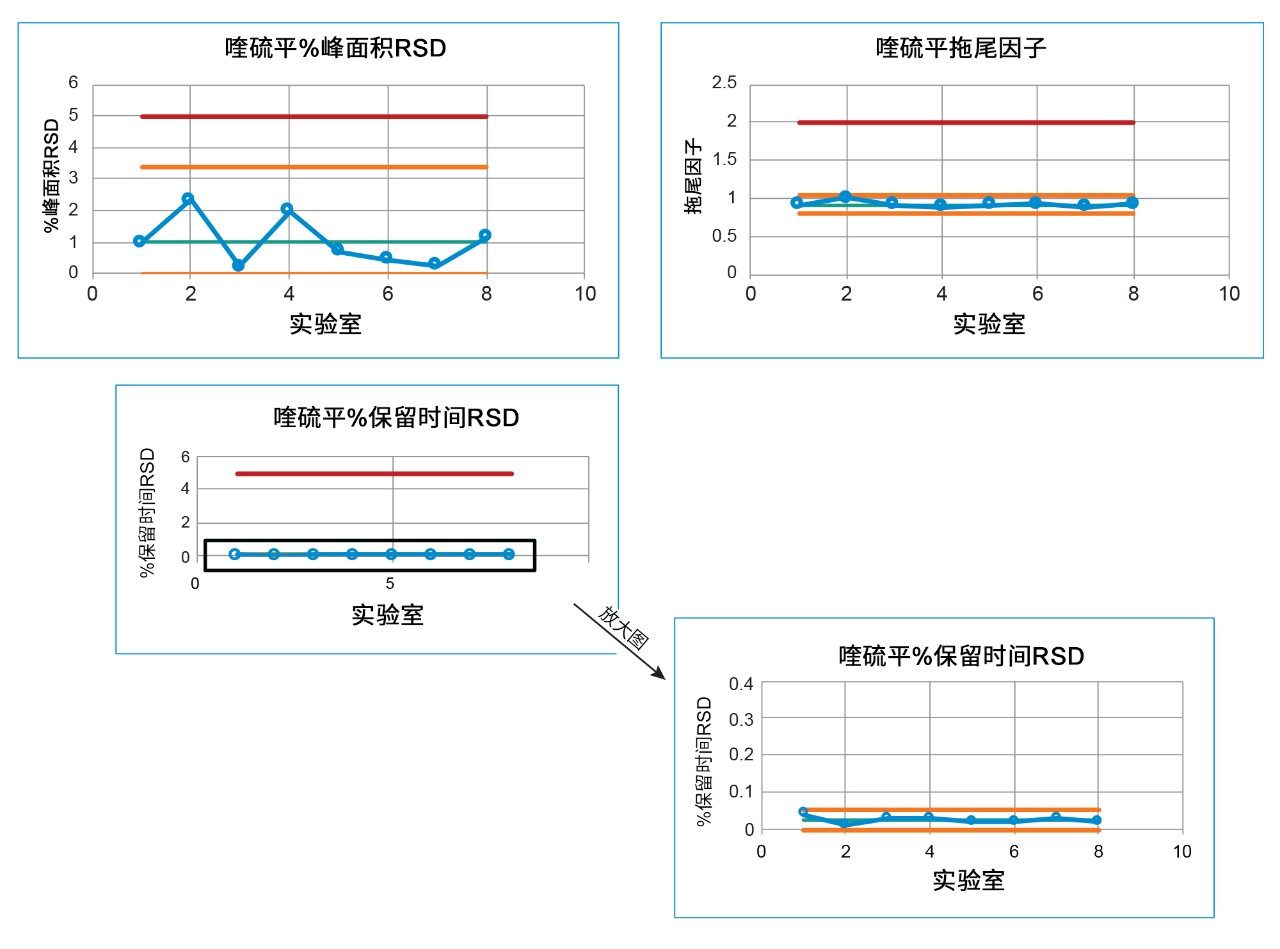
在系统适应性评估的第二部分,需要分析标准溶液的拖尾因子、保留时间%RSD和峰面积%RSD。从所有实验室得到的标准溶液的色谱结果(图4)可以看出,所有系统适应性要求结果均处于质量标准范围内,包括拖尾因子不大于2.0、保留时间RSD不超过5%且峰面积%RSD不超过5%。从这些结果中可以看出,某些系统的峰面积%RSD较大,而USP拖尾因子和保留时间%RSD则相当(图5)。这些实验室(2、4和8)中的系统由PDA检测器组成,而其他实验室均使用的是TUV检测器。故将检测器确定为导致差异的关键原因。
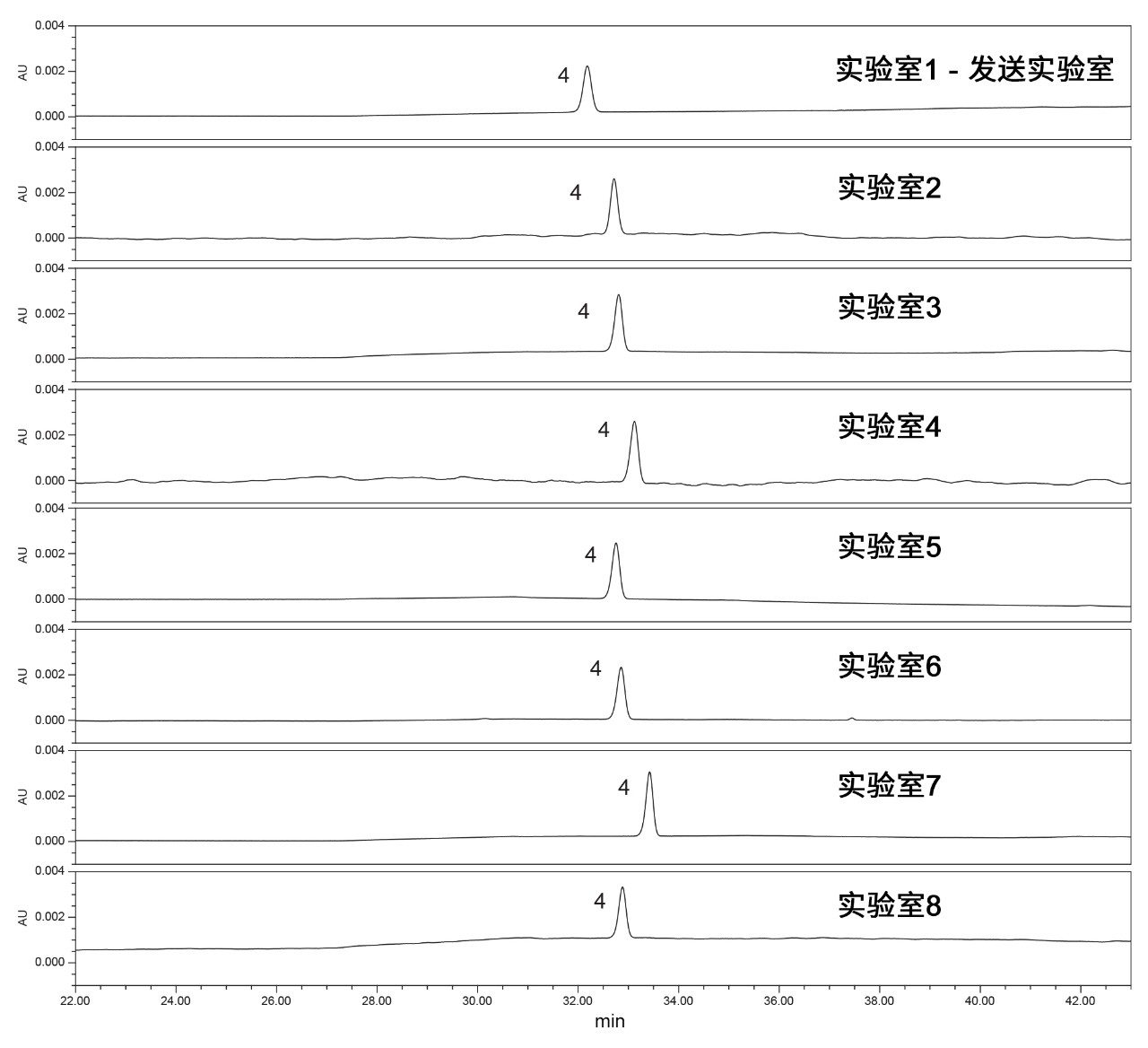
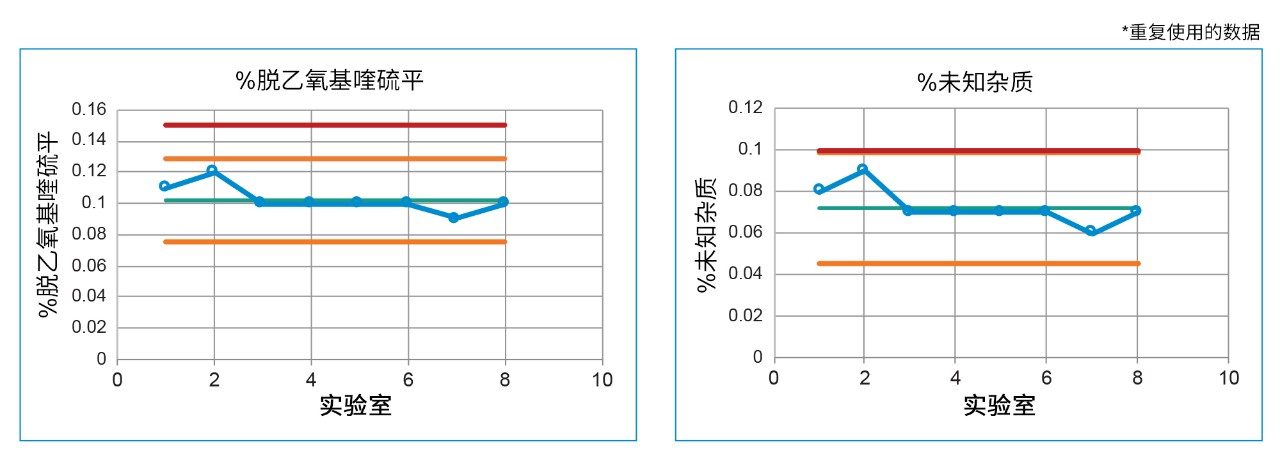
当所有仪器均满足系统适应性要求后,即可分析样品溶液或原料药中是否存在杂质。定量分析结果表明,样品溶液中存在脱乙氧基喹硫平(经标准品验证)和一种未知杂质。保留时间处于平均值±3倍标准偏差的预期变化范围内(图6),且所有实验室得到的样品溶液中脱乙氧基喹硫平和未知杂质的定量结果相当。所有结果都处于可接受标准范围内,即脱乙氧基喹硫平的结果偏差不超过0.15%、未知杂质的结果偏差不超过0.10%。由于原料药已经过期,因此存在杂质不足为奇。控制图比较发现定量结果在±3倍标准偏差内,表明处于受控状态。此外,控制限值小于或等于USP方法中规定的限值,提高了原料药符合标准的可信度。
使用基于风险的方法,将富马酸喹硫平的USP杂质分析方法成功转换至全球八个实验室的Arc HPLC仪器。了解液相色谱系统配置有助于制定控制策略并提供更好的控制,由此提高满足系统适应性标准的可能性。此外,了解方法性能的风险并实施控制策略有助于提高重现性。通过这项实验室间研究,我们证明了全球范围内利用Arc HPLC系统重现USP专论方法的能力。
720007285ZH,2021年6月