
本应用纪要介绍了一种灵敏且稳定的多残留分析方法,使用ACQUITY UPLC I-Class PLUS与Xevo TQ-S micro MS/MS联用系统来测定18种大环内酯类抗生素。
大环内酯类抗生素(例如螺旋霉素、泰乐菌素和红霉素)是碱性亲脂性分子,由14~16元内酯环组成,内酯环上连接有糖基。林可酰胺类抗生素(如林可霉素和吡利霉素)在结构上与大环内酯类抗生素截然不同,但他们都有相似的作用机制。大环内酯类和林可酰胺类抗生素已获得广泛批准,作为兽药用于治疗呼吸系统疾病。此外,某些国家和地区允许将大环内酯类抗生素用作饲料添加剂,以提高饲料转化率并促进动物生长。
虽然兽药在畜禽生产中发挥着重要作用,但误用大环内酯类抗生素或缩短治疗后的休药期却可能导致动物组织及相关食品中存在大环内酯类抗生素残留,增加消费者的潜在风险,导致抗生素敏感人群产生过敏反应。为保护人类健康,政府已出台相关法规保障消费者免受动物源性食品中抗生素残留可能带来的有害影响(例如欧盟的法规(EU) 2019/6)1。相关法规从科学角度规定了兽药产品的最大残留量(MRL)。最大残留量是指动物源性食品中允许存在的药物活性物质残留的最大浓度。大环内酯类抗生素的MRL差异很大,具体取决于动物种类和目标组织以及不同国家/地区的要求2,3。 大环内酯类抗生素是由各种链霉菌属菌种产生的,所以它们往往是多组分系统,含有的相关化合物较少。例如,泰乐菌素主要由泰乐菌素A组成,但也含有不同含量的脫碳霉糖泰乐菌素(泰乐菌素B)、大菌素(泰乐菌素C)和雷洛霉素(泰乐菌素D)。我们通常将组织中丰度最高的组分作为残留标志物(例如,泰乐菌素中的泰乐菌素A)。由于泰拉霉素及其大多数代谢物可通过酸水解转化为已知代谢物CP-60,300,因此EU选择该化合物作为泰拉霉素的残留标志物,并确定了MRL,将其定义为泰拉霉素及其代谢物水解生成的残留标志物(CP-60,300)的总和,并以泰拉霉素当量表示。由于在通过一种方法分析多种大环内酯类抗生素时难以加入水解步骤,因此我们认为本应用纪要介绍的方法适用于筛查泰拉霉素。
如果结果疑似不合规,则使用符合残留定义且经过验证的确认方法重复分析,同时在方法中加入水解步骤。残留监测计划旨在检测食品动物中非法使用或滥用授权兽药的情况,并调查残留违规的原因。在某些情况下,比如向欧盟出口食品的国家也必须实施残留监测计划,以保证同等水平的食品安全。
食品行业经营者还需要开展化学分析,检查当前供应链的动物组织中是否存在残留,以便进行尽职调查和阳性放行。除了检查MRL合规性方面的需求以外,抗生素耐药性及其对人类健康的威胁也日益受到关注。如今,食用动物病原体(包括一些动物源性细菌)对大环内酯类和林可酰胺类抗生素产生了获得耐药性4。
因此,我们需要开发简单而准确的方法,用于测定各种动物组织中抗生素的残留量。本应用纪要验证了一种使用Waters ACQUITY UPLC I-Class PLUS与Xevo TQ-S micro联用系统来测定牛肌肉组织中18种大环内酯类抗生素兽药的分析方法。
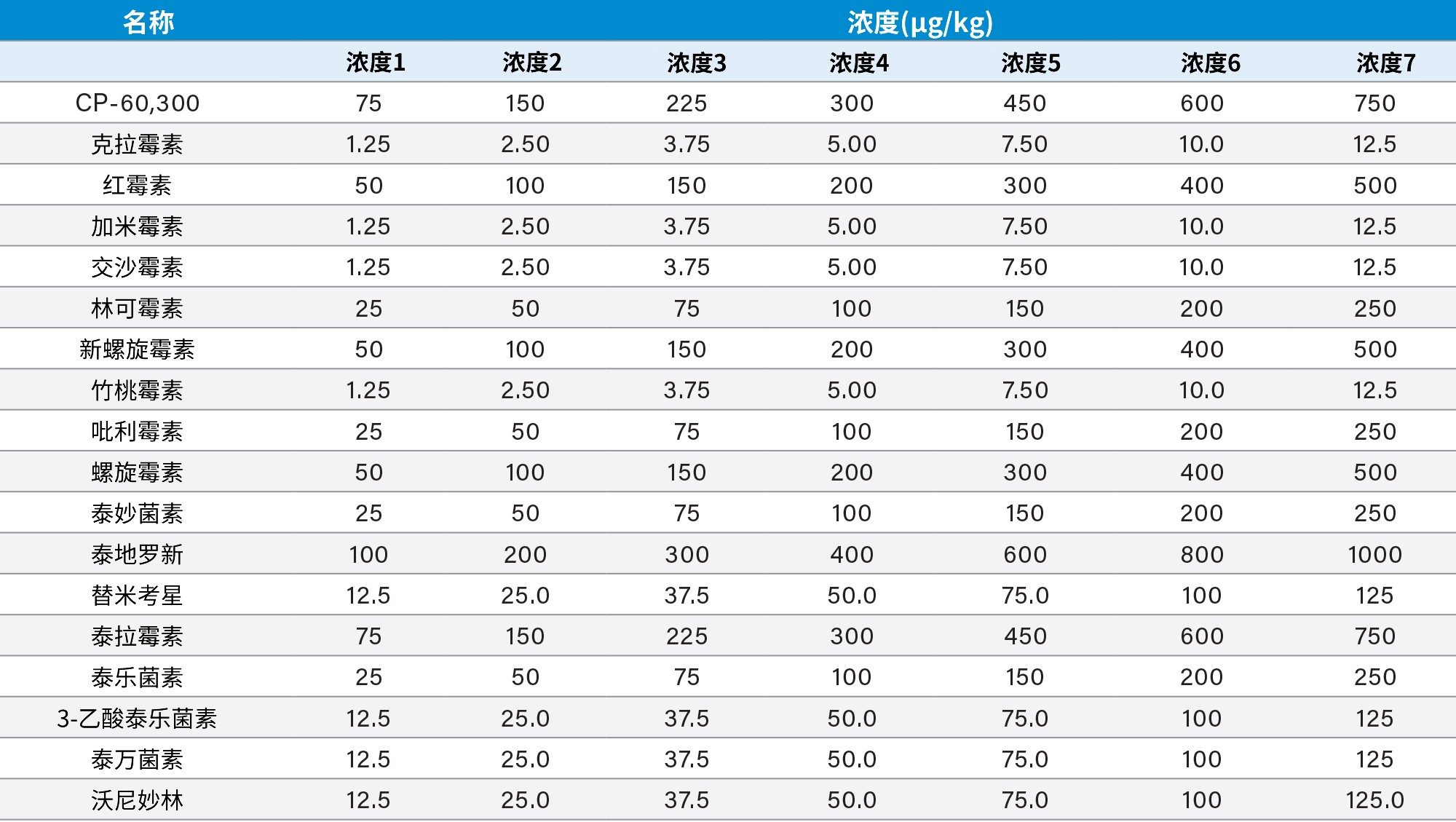
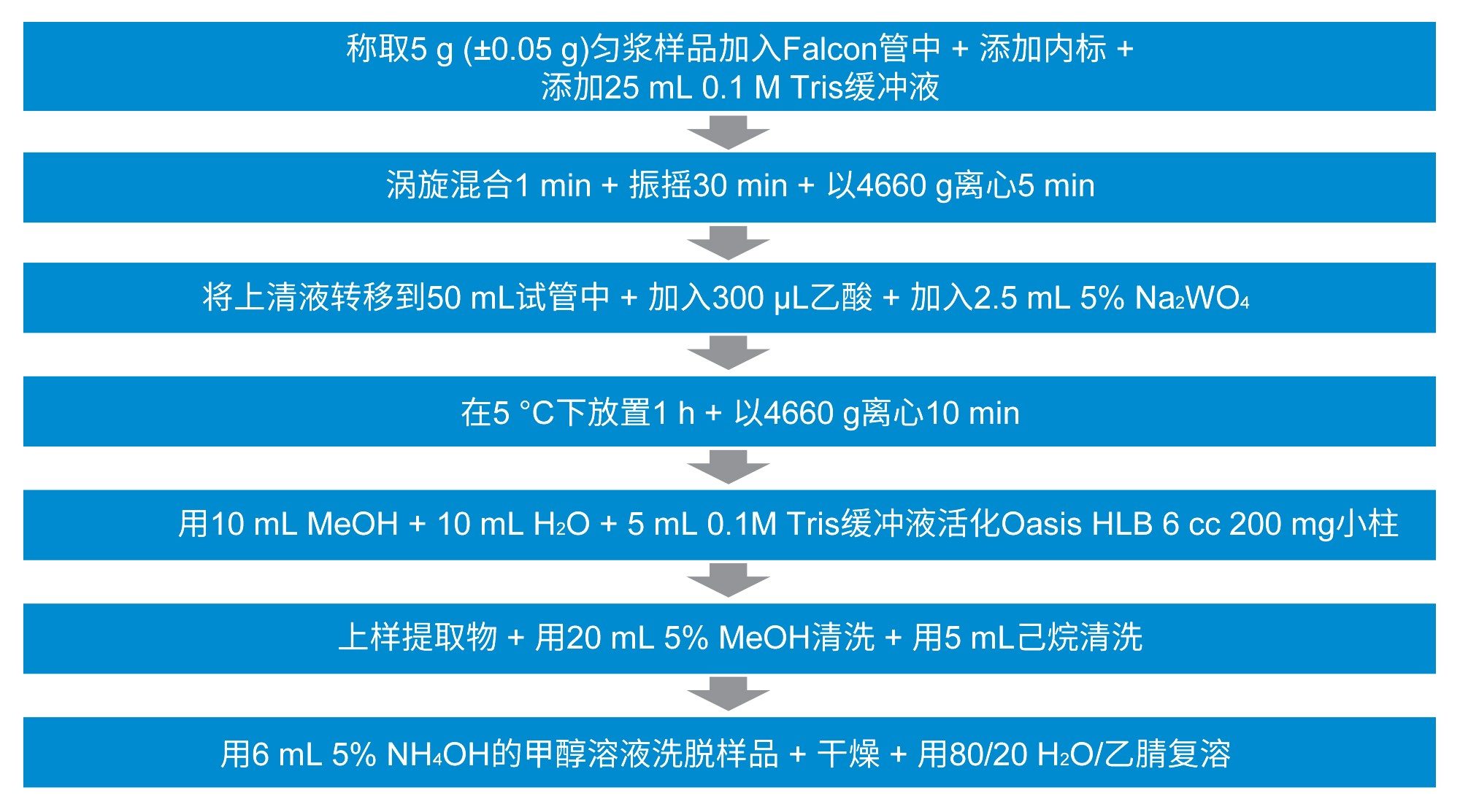
加入内标后,使用液相萃取法提取牛肌肉组织,然后进行SPE净化(详见图1)。用牛肌肉组织提取物(之前显示为空白)制备基质匹配标准品,浓度如表1所示。
|
系统: |
配备FTN样品管理器的ACQUITY UPLC I-Class PLUS |
|
色谱柱: |
ACQUITY HSS T3 2.1 × 100 mm(P/N:186003539) |
|
柱温: |
50 °C |
|
样品温度: |
10 °C |
|
进样参数: |
1 μL |
|
流动相A: |
水 + 0.1%甲酸 |
|
流动相B: |
乙腈 + 0.1 %甲酸 |
|
样品管理器清洗液: |
甲醇 |
|
时间 |
流速(mL/min) |
%A |
%B |
曲线 |
|---|---|---|---|---|
|
0.00 |
0.4 |
90 |
10 |
? |
|
0.50 |
0.4 |
90 |
10 |
6 |
|
7.50 |
0.4 |
43 |
57 |
6 |
|
9.00 |
0.5 |
0 |
100 |
1 |
|
10.00 |
0.4 |
90 |
10 |
1 |
|
MS系统: |
Xevo TQ-S micro |
|
极性: |
ES+ |
|
毛细管电压: |
1.0 kV |
|
离子源温度: |
150 °C |
|
脱溶剂气温度: |
500 °C |
|
脱溶剂气流速: |
1000 L/h |
|
锥孔气流速: |
50 L/h |
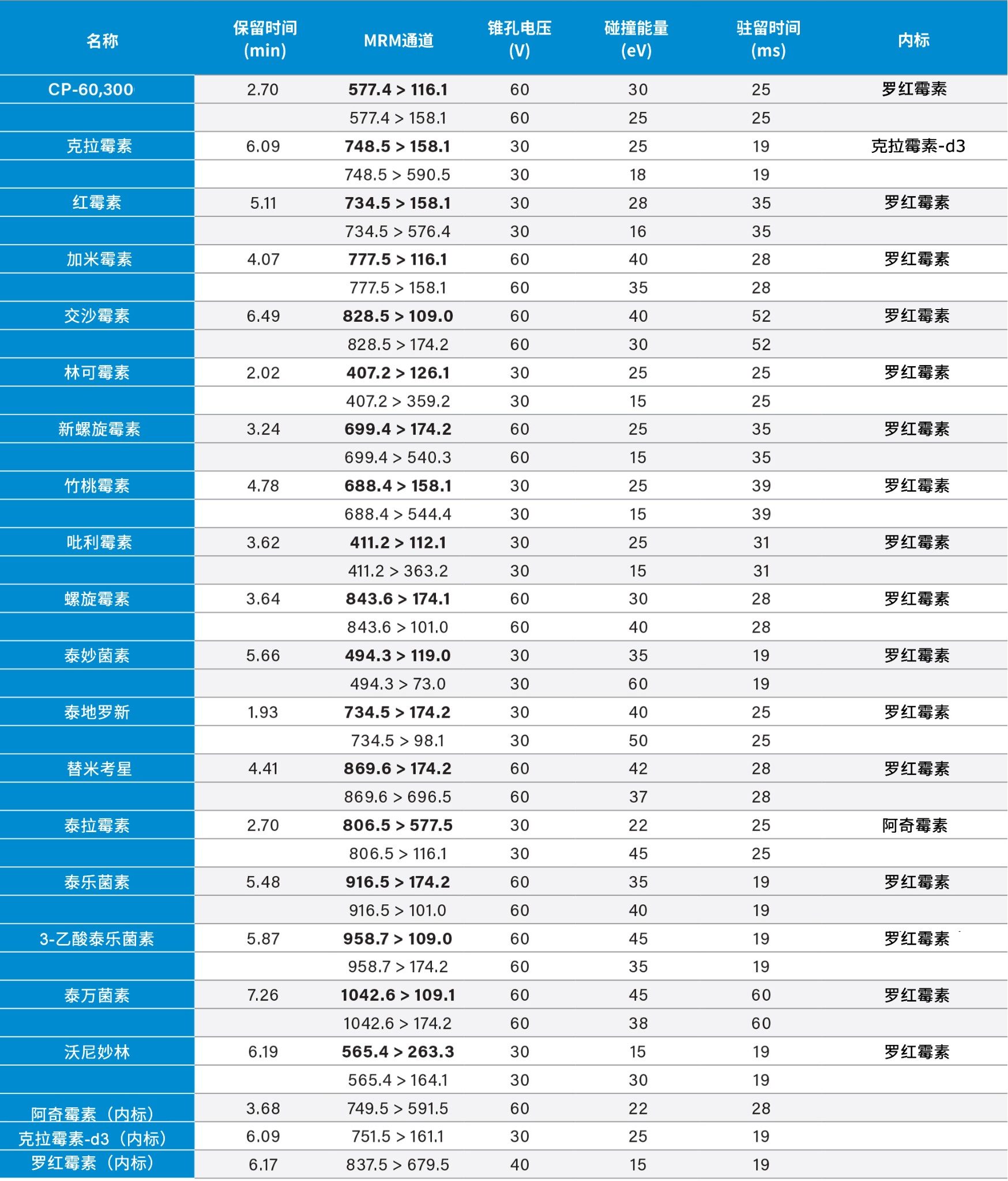
每种化合物采用两个MRM通道。利用Autodwell功能自动设置驻留时间,使每个峰至少包含12个数据点。利用MassLynx软件采集数据,并用TargetLynx XS应用软件处理数据。表2总结了MRM通道和实际驻留时间设置。定量迹线以粗体显示。
验证依据欧盟委员会指令2002/657/EC指导原则进行5。 评估以下参数:鉴定结果、选择性、线性、正确度(用回收率表示)、实验室内重复性(RSDr)、实验室内重现性(RSDRL)、决定限度(CCα)和检出容量(CCβ)。通过检查保留时间、离子丰度比和鉴定点来评估鉴定结果。通过分别进样所有分析物和内标的标准溶液并检测不同牛的牛肌肉样品来研究该方法的选择性,检查是否存在任何干扰物质在分析物保留时间处及其附近流出。对曲线的线性和各个残差进行检查。根据重复加标样品的数据得出正确度、RSDr和RSDRL,这些样品由同一分析人员在三天内进行分析。对于规定了MRL的物质,分别在现行立法规定的0.5、1和1.5倍MRL下对参数进行评估。对于EU未规定MRL的化合物,则以目标含量(TL)的0.5、1和1.5倍进行评估。CCα和CCβ依据2002/657/EC中规定的RSDRL进行计算。
HSS T3色谱柱为所有分析物提供了优异的保留性能和峰形(图2)。所有峰均在1.9~7.3 min之间洗脱,总运行时间为11 min。
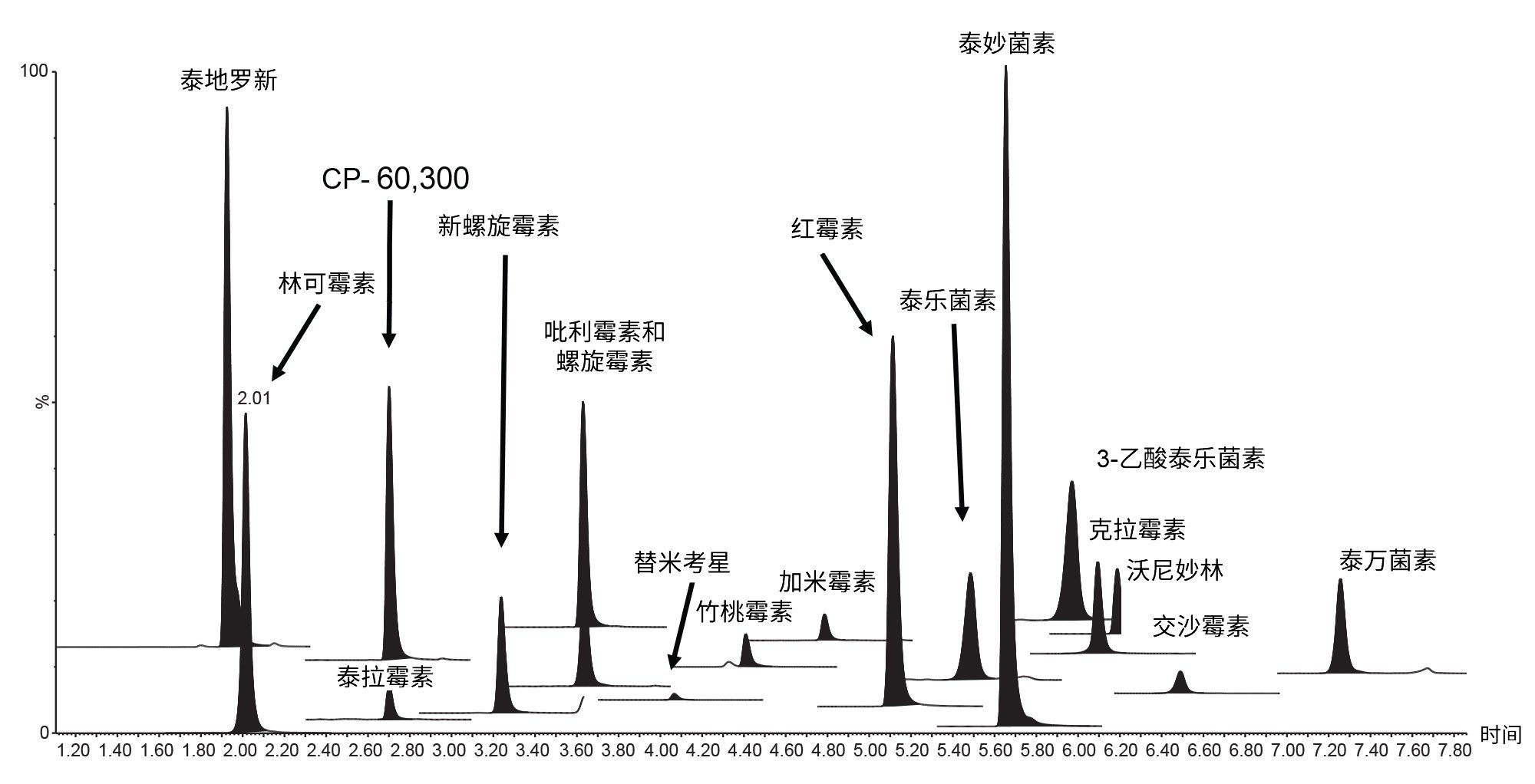
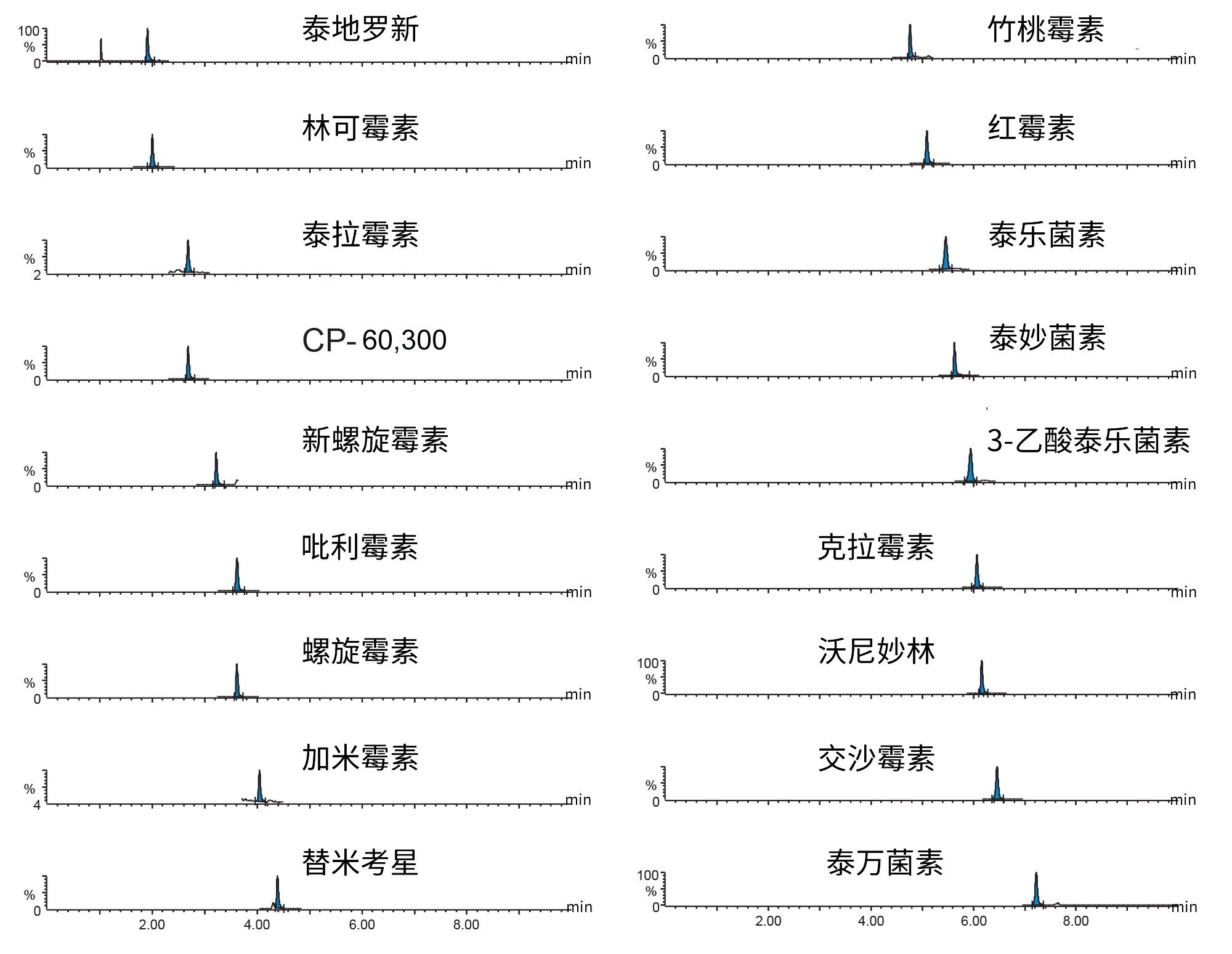
在这三天中的每一天都制备并分析一共七个空白样品,在目标分析物的预期洗脱区域内未发现显著干扰,由此表明该方法的特异性良好。对痕量水平的克拉霉素(约0.1 μg/kg)、吡利霉素(约0.7 μg/kg)和泰万菌素(约0.3 μg/kg)进行了检测,但浓度远低于MRL。每种分析物采用两个通道足以满足所需的鉴定点(对于规定了MRL的物质为三个,对于违禁物为四个),所得峰的离子丰度比和保留时间均处于相较于标准品建议的偏差范围内。利用基质提取物绘制7点校准曲线,每天采集一次数据。采用1/X加权二次拟合,基质验证曲线的决定系数值(R2)几乎全部 > 0.99,各残差 < 2 0%,这证明所有大环内酯类抗生素的定量十分可靠。第1天泰万菌素校准曲线的R2值为0.98。典型校准曲线的一些示例见图3。
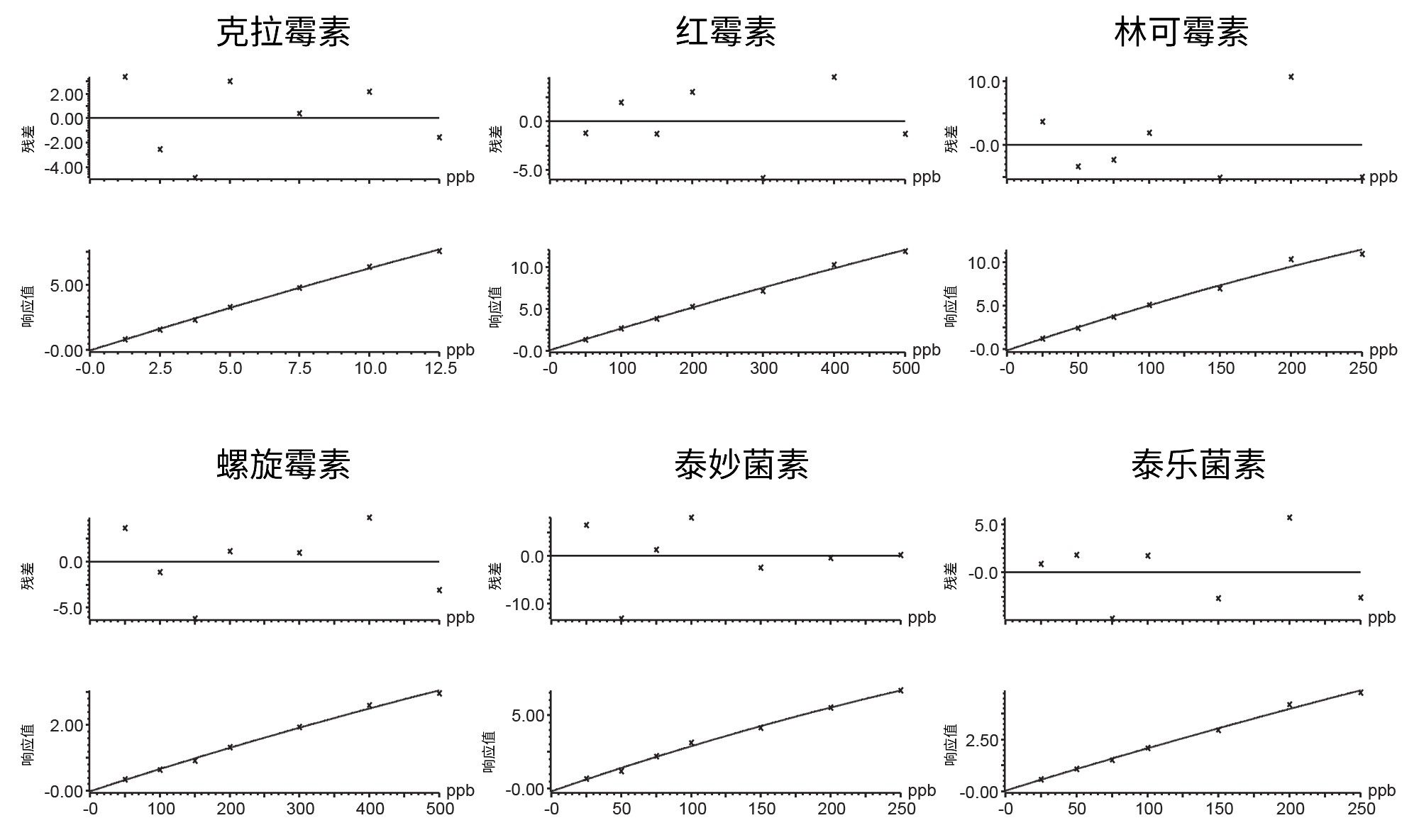
基质匹配标准品曲线的分析结果表明,该方法具有出色的灵敏度。图4所示为分析最低浓度的基质匹配标准品获得的一系列大环内酯类抗生素的典型色谱图,表明该方法能够检测提取物中更低浓度的大环内酯类抗生素。因此我们可以进一步稀释最终提取物,从而减轻基质效应并进一步减少潜在的系统污染。
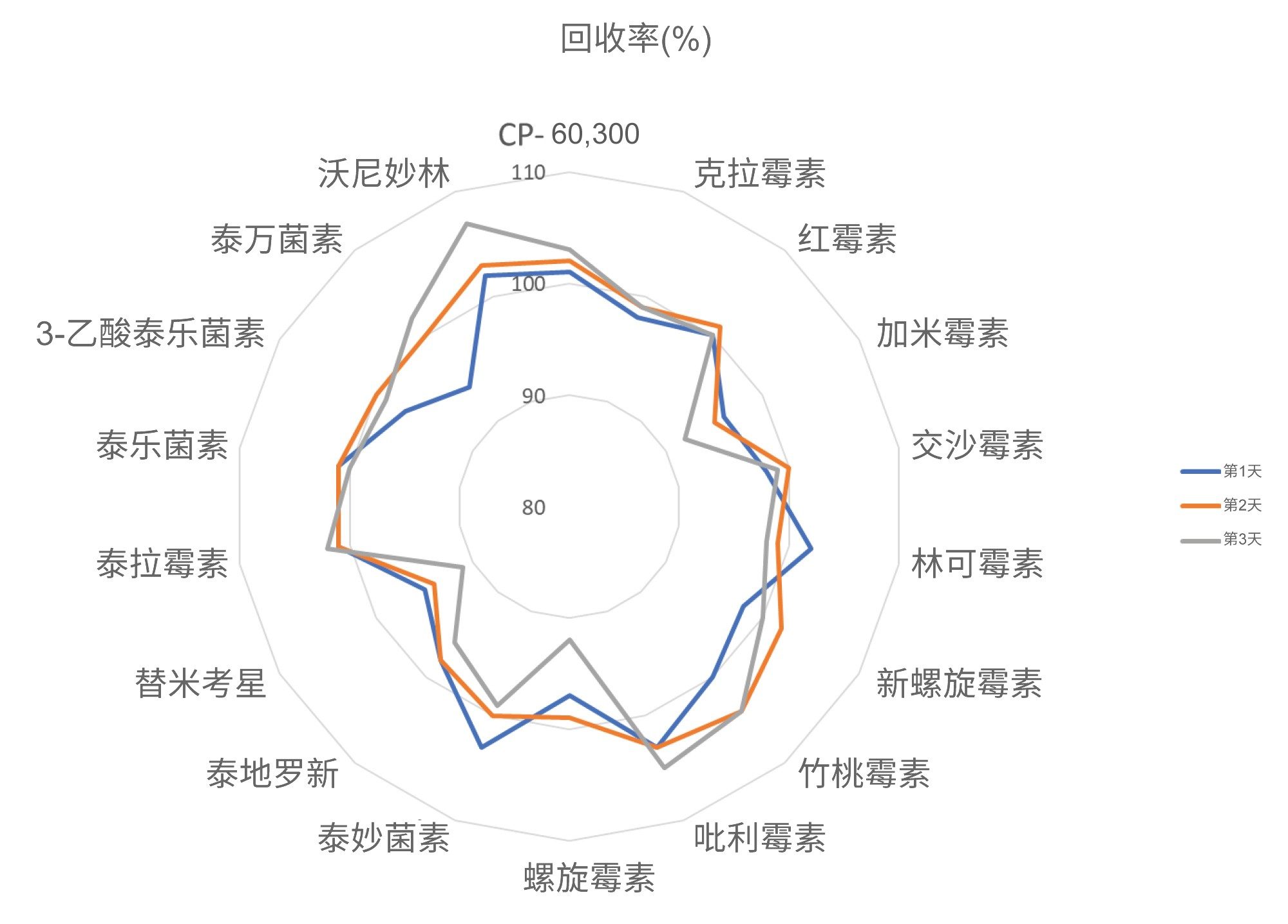
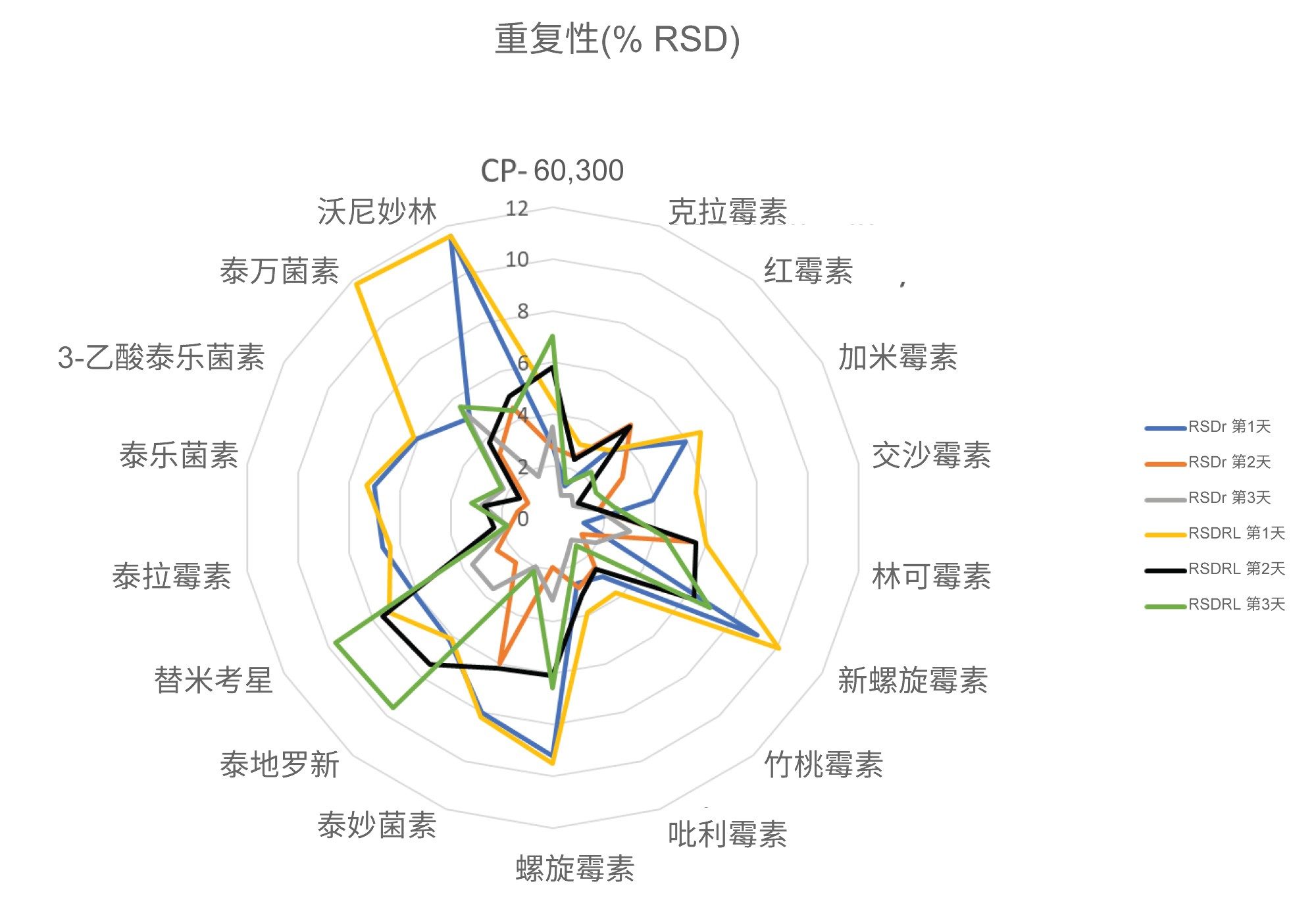
使用三天内分析加标样品得到的数据评估正确度,以实测回收率表示。在三天内制备三种浓度的加标样品,每组七个,并进行分析,所得平均回收率在81%~111%的范围内。除CP-60,3000外,其他残留物的正确度值均在可接受范围内。CP-60,3000的定量分析使用了罗红霉素作为内标,这可能是导致略微失败的原因(95%~111%;即,超出110%的限值)。在RSDr (0.9%~11.6%)和RSDRL (1.4%~11.6%)研究中,该方法对所有分析物的重复性也令人满意。正确度和重复性结果见图5、图6和表3,表中还列出了CCα和CCβ值。
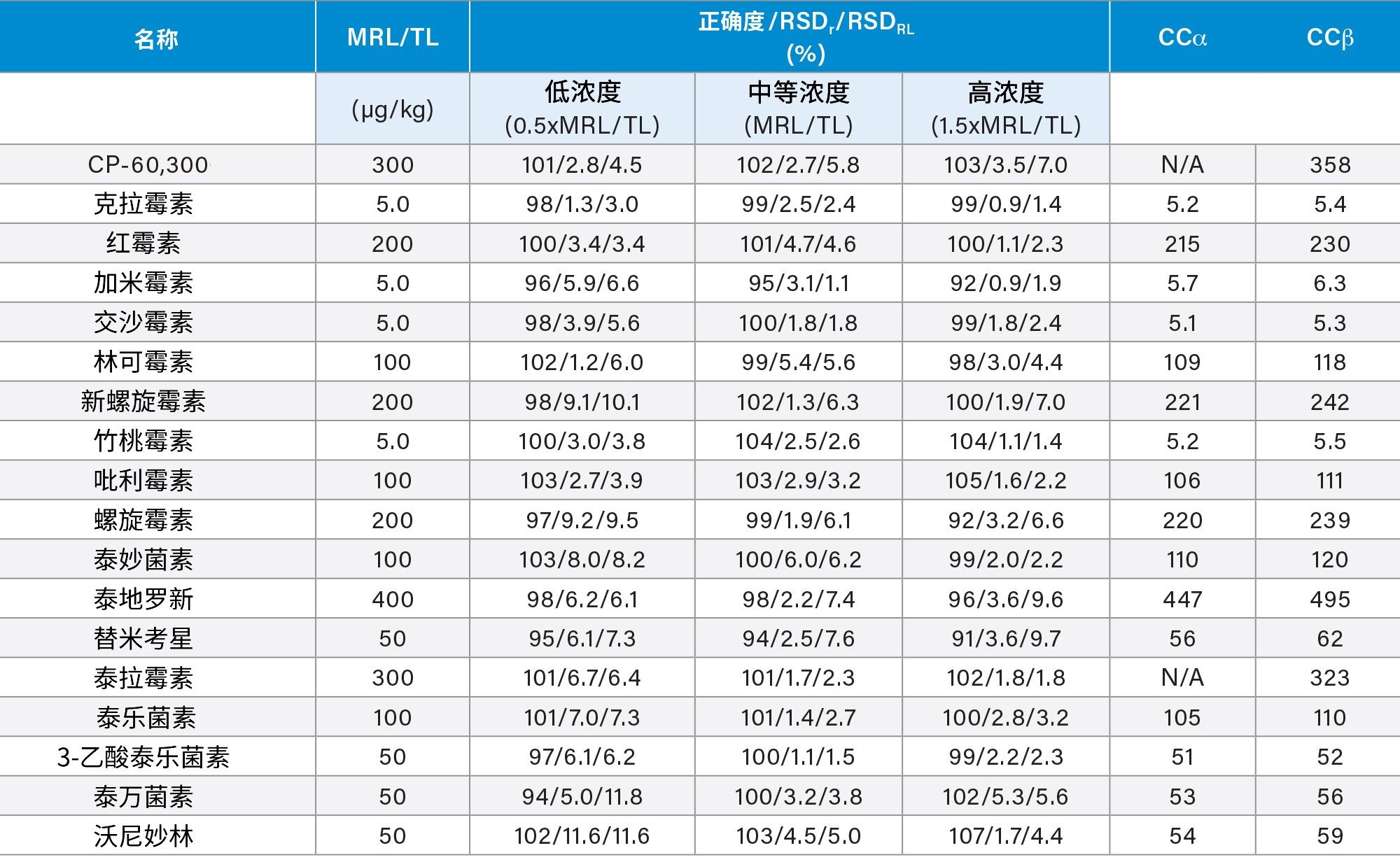
经证明,本应用纪要所述的使用ACQUITY UPLC I-Class PLUS与Xevo TQ-S micro MS/MS联用系统来测定18种大环内酯类抗生素的方法是一种灵敏且稳定的多残留分析方法。该方法能够快速可靠地对浓度远低于典型MRL的分析物进行定量分析,并依据欧盟委员会指令2002/657成功验证,在对牛肌肉组织中的所有大环内酯类抗生素的分析中提供了令人满意的结果。经适当验证后,该方法也可用于其他动物和鱼类组织的分析。
720006750ZH,2020年2月